19.06.2019
Sådan balancerer du de vigtigste hormoner ved hjælp af ernæring. Hormonelle niveauer i tilfælde af spiseforstyrrelser hos patienter med metabolisk syndrom Blodprøve for T4 thyreoideahormon: normer og årsager til ændringer
Når vores hormonsystem er afbalanceret, fungerer hormonerne som kloge mentorer for kroppen, og sender "gør dette" eller "gør det" kommandoer til vores krops celler for at sikre homeostase.
Homeostase er selve tilstanden, når du har lækkert tykt hår, stærke negle, klar hud, stabilt humør og vægt, du er stress-resistent, har god fordøjelse og libido.
Men desværre er vores hormonsystem allerede meget modtageligt for miljøpåvirkninger, især påvirkningen af toksiner, dårlig søvn, underernæring, ustabilitet i tarmmikrofloraen og endda dårlige tanker.
Der er 5 vigtigste hormoner, der påvirker kroppens homeostase, og for at bringe dem i balance, er det ikke nødvendigt straks at ty til lægemidler eller kosttilskud, først bør du prøve at regulere situationen ved hjælp af særligt udvalgte produkter, der har evnen til at genoprette hormonbalancen.
1. Høj kortisol
Hvordan arbejder han:
Kortisol er det vigtigste stressresponshormon og produceres af binyrerne. Forhøjede kortisolniveauer fører til en stigning i blodtryk og sukkerniveauer. Kronisk høje niveauer af hormonet kan føre til følelser af øget ophidselse eller akavethed i kroppen, depression, tidlig aldring, vægtøgning, blodsukkerproblemer og metabolisk syndrom.
Hvad du måske bemærker:
- Føler du konstant er på flugt og laver den ene opgave efter den anden.
- Vanskeligheder med vægttab, især omkring taljen.
- Hyppige humørsvingninger eller depression.
- Manifestationen af en øjeblikkelig reaktion af vrede eller raseri.
- Besvær med at slappe af om aftenen og dårlig søvn.
- Svage negle eller hudproblemer såsom eksem eller tynd hud.
- Højt blodtryk eller højt blodsukker (eller begge dele).
- Hukommelsen svigter eller manglende opmærksomhed, især i perioder med stress.
- Trang til salt eller sød mad.
- Lav libido.
Fødevareløsning:
Ekstra mørk chokolade kan sænke niveauet af hormonet kortisol. Du kan også bruge fisk dyrket under naturlige forhold fra tid til anden. Lækker medicin, ikke?!
2. For meget testosteron
Hvordan arbejder han:
Testosteron er et hormon, der produceres i kvinders æggestokke, mænds testikler og binyrerne. Det er meget vigtigt for at føle velvære, selvtillid, opretholde muskeltonus, knoglevækst og seksuel funktion. 30 % af kvinderne oplever for høje niveauer af det, hvilket kan føre til akne, uregelmæssig menstruation, øget kropshårvækst, hårtab på hovedet og infertilitet.
Hvad du måske bemærker:
- Acne.
- Ekstra hår på bryst, ansigt og arme.
- Fedtet hud og hår.
- Hårtab på hovedet (nogle gange kombineret med overdreven vækst af kropsbehåring).
- Misfarvning af armhulerne: De bliver mørkere og tykkere end din normale hud.
- Papillomer, især på halsen og overkroppen.
- Hyperglykæmi eller hypoglykæmi eller ustabilt blodsukker.
- Kort temperament eller irritabilitet, alt for aggressiv autoritær adfærd.
- Depression eller angst.
- Polycystisk ovariesyndrom, typisk med ovariecyster, infertilitet og menstruationscyklusser mindre end hver 35. dag.
Fødevareløsning:
Spis flere grønne bønner, samt græskar- og græskarkerner, som alle er rige på zink, som spiller en vigtig rolle i seksuel udvikling, menstruation og ægløsning. Zinkmangel er forbundet med acne og forhøjede niveauer af androgener, en gruppe hormoner, som testosteron tilhører.
Klik på " Synes godt om» og få de bedste opslag på Facebook!
103. Indikatorer, der karakteriserer tilstanden af lipidmetabolisme i kroppen. Indhold og metoder til bestemmelse i blod.
104. Flerumættede fedtsyrer er essentielle ernæringsmæssige faktorer. Polyensyrernes rolle som kilde til eicosanoider. Uddannelse, biologisk rolle, deltagelse af prostaglandiner og leukotriener i reguleringen af stofskifte og kropsfunktioner. Anti-inflammatorisk virkning af inhibitorer af eicosanoid syntese.
105. Hormonel regulering af metabolismen af kulhydrater, fedt og aminosyrer ved insulin. Indflydelse af kostrytme på hormonstatus.
106. biologisk oxidation. De vigtigste stadier af foreningen af energimateriale. Kataboliske processer er de vigtigste kilder til brintdonorer til respirationskæden. Intramitochondrial og ekstramitochondrial kilder til NADH.
107. Oxidative processer er kilder til NADH. Shuttle enzym-substratsystemer til hydrogenoverførsel til mitokondrier. Procesværdi.
108. Begrebet katabolisme og anabolisme og deres forhold. Endergoniske og eksergoniske reaktioner i stofskiftet. ATP og andre højenergiforbindelser. ADP-ATP cyklus. Hovedveje for ADP-phosphorylering og ATP-udnyttelse. Måder at bruge ilt af væv.
109. Karakteristika for den sidste fase af oxidative processer. Strukturel organisering af elektron- og protontransportkæden. ATP - syntetase, ATP-syntese. ATP er den universelle kemiske form for energilagring i cellen. Mekanismen for konjugation af oxidation og phosphorylering. Karakterisering af Mitchell-Skulachev kemiosmotiske teori om oxidativ phosphorylering.
110. Terminal fase af biologisk oxidation. Organisation af respirationskæden i mitokondrier. Kobling af oxidation med phosphorylering i respirationskæden. H+-ATP-syntetase. Respiratorisk kontrol. Afkobling af respiration og fosforylering. Hypoenergetiske tilstande.
111. Alternative funktioner af cellulær respiration: Mikrosomal oxidation. De vigtigste enzymer i den mikrosomale elektrontransportkæde. De vigtigste mekanismer til neutralisering af endogene og fremmede giftige stoffer. Den første og anden fase af omdannelsen af fremmede stoffer.
112. Prooxidant- og antioxidantprocesser. Dannelse af reaktive oxygenarter. Repræsentanter. Mekanismen for den skadelige virkning af biomolekyler og strukturer. Antioxidant forsvarssystem.
113. Enzymer af antioxidantsystemet. Katalase, struktur, funktioner. Bestemmelse af enzymatisk aktivitet.
114. Fysiologiske funktioner af blod, osmotisk og onkotisk tryk. Proteiner og mineralske komponenter i vedligeholdelsen af blodplasma.
115. Fysiske og kemiske parametre for blod. Værdien af pH-konstans i organismens liv. Buffersystemer, eksempler, biologisk rolle.
116. Konceptet om blodets syre-base tilstand. Overtrædelser af syre-base balancen. Acidose og alkalose, typer.
117. Blodplasmaproteiner. Klassificering, indhold, adskillelsesmetoder. Karakteristika for individuelle fraktioner. biologisk rolle.
118. Blodplasma albumin. biologisk rolle. Indhold. Metoder til kvantitativ bestemmelse.
119. Blodens enzymer, klassificering, kilder, diagnostisk værdi af bestemmelsen. De vigtigste indikatorenzymer i blodet.
120. Ikke-protein nitrogenholdige og nitrogenfrie organiske stoffer i blodet. Indhold, rolle i livsprocesser.
121. Moderne koncepter for blodkoagulationssystemet. Plasma- og blodpladefaktorer. rolle i hæmostase.
122. Rullesystem. Eksterne og interne koagulationsveje. antikoagulerende system.
123. Mineraler som mikronæringsstoffer. Kilder og behov. Mineralers generelle funktioner.
124. Specifik rolle i kroppens liv af natrium, kalium, klorioner. Kalium, natrium, blodklorider. Hypo- og hypernatriæmi, hypo- og hyperkaliæmi. Kvantitativ bestemmelse af blodserumklorider.
125. Calcium, magnesium og fosfor. Metoder til bestemmelse af serumcalcium, diagnostisk værdi. biologisk rolle. Regulering af calcium- og fosforstofskiftet. Rollen og mekanismen for hormonkontrol. Inddragelse af D-vitamin.
126. Jern, kilder, behov, absorption, transportproteiner, aflejring, biologisk rolle.
127. Kobber. Biologisk rolle, bestemmelsesmetoder.
128. Sporstoffer: jod, fluor, kobber, mangan, specifikke funktioner.
129. Vand eksogent og endogent, kilder, behov. Vands biologiske rolle. Regulering af udvekslingen af vand, natrium og kalium i kroppen.
130. Regulering af vand-salt metabolisme. Struktur, metabolisme og virkningsmekanisme af vasopressin og aldosteron. Renin-angiotensin system. Biokemiske mekanismer for udvikling af renal hypertension.
131. Biokemi af nervevæv. Funktioner af energimetabolisme. Behovet for ilt. Metabolisme af kulhydrater, kilder. Glucosens rolle i hjernens substrat og energiforsyning.
132. Hjernens kemiske sammensætning. Proteiner, funktionel klassificering. Neurospecifikke proteiner i nervevævet. Fund af frie aminosyrer. Funktioner ved udveksling af dicarboxylsyrer.
133. Lipider og kulhydrater i hjernen: repræsentanter, biologisk rolle. Funktioner ved udvekslingen.
134. Neurotransmittersystemer, kriterier. Excitatoriske og hæmmende neurotransmittere. Repræsentanter, karakteristika, uddannelse og inaktivering.
135. Fund af frie aminosyrer i hjernen. Metoder til metabolisme af glutaminsyre. GABA-dannelse, rolle i hjernen.
136. Biogene aminers rolle i udførelsen af hjernefunktioner. Katekolaminer, indolaminer, histamin. Uddannelse, specifikke funktioner i hjernen, inaktivering.
137. Biologisk aktive peptider af nervevæv. Rolle i opfattelsen af smerte og anæstesi, i reguleringen af autonome og højere funktioner i nervesystemet.
138. Begrebet hukommelsens biokemi. Typer af hukommelse, dannelsesmekanisme.
139. Biokemi af muskelvæv. Muskelproteiner: myosin, antine, actomyosin, tropomyosin, troponin. Sarkoplasmatiske proteiner.
140. Biokemiske mekanismer for muskelsammentrækning og afslapning. Rollen af regulatoriske proteiner, calcium. Energiforsyningsmekanismer.
141. Ikke-protein nitrogenholdige ekstraktionsstoffer, nitrogenfri muskelstoffer.
142. Funktioner af den kemiske sammensætning og metabolisme af hjertemusklen.
143. Bindevæv. Struktur og struktur af kollagen og elastin, egenskaber, biologisk rolle. C-vitamins rolle i kollagenbiosyntesen.
144. Bindevæv. Intercellulær matrix. Glycosaminoglycaner, proteoglycaner og glycoproteiner. Struktur, funktioner, repræsentanter. Kvalitativ test for sulfaterede glycosaminoglycaner i urin. Den diagnostiske værdi af definitionen.
145. Knoglevæv: mineralsk og organisk sammensætning. Funktioner af knoglevæv.
146. Biokemiske ændringer i bindevæv under aldring og nogle patologiske processer.
147. Biokemi af leveren. Funktioner af metabolisme, rollen i kroppens liv.
148. nyrernes udskillelsesfunktion. karakteristika ved diurese. Fysisk-kemiske parametre for urin.
149. Generelle egenskaber af urin: diurese, farve, gennemsigtighed, reaktion, tæthed. Udsving i normen og patologien. Undersøgelsesmetoder.
150. Den kemiske sammensætning af urin: organiske og uorganiske komponenter.
151. Patologiske komponenter i urin: protein, blod, ketonstoffer, bilirubin. Årsager til forekomst, metoder til påvisning.
152. Karakteristika for slutprodukterne af nitrogenmetabolisme. Kvantitativ bestemmelse af kreatinin i blodet.
Lignende information.
Modulstruktur | Emner |
Modulær enhed 1 | 11.1. Hormoners rolle i reguleringen af stofskiftet 11.2. Mekanismer for transmission af hormonelle signaler til celler 11.3. Strukturen og syntesen af hormoner 11.4. Regulering af udveksling af hovedenergibærere med en normal ernæringsrytme 11.5. Ændringer i stofskiftet under hypo- og hypersekretion af hormoner |
Modulær enhed 2 | 11.6. Ændringer i hormonstatus og stofskifte under faste 11.7. Ændringer i hormonstatus og stofskifte ved diabetes mellitus |
Modulær enhed 3 | 11.8. Regulering af vand-salt metabolisme 11.9. Regulering af calcium- og fosfatmetabolisme. Struktur, syntese og virkningsmekanisme af parathyreoideahormon, calcitriol og calcitonin |
Modulær enhed 1 HORMONERS ROLLE I REGULERING AF METABOLISME. REGULERING AF METABOLISMEN AF KULHYDRATER, LIPIDER, AMINOSYRER MED EN NORMAL KOSTRYTME
Læringsmål At kunne:
1. Anvende viden om de molekylære mekanismer for regulering af stofskifte og kropsfunktioner til at forstå det biokemiske grundlag for homeostase og tilpasning.
2. At bruge viden om hormoners virkningsmekanismer (insulin og kontrainsulære hormoner: glukagon, kortisol, adrenalin, somatotropin, iodthyroniner) til at karakterisere ændringer i energistofskiftet ved ændring af fordøjelsesperioder og postabsorptiv tilstand.
3. Analyser ændringer i stofskiftet under hypo- og hyperproduktion af kortisol og væksthormon, Itsenko-Cushings sygdom og syndrom (akromegali), samt hyper- og hypofunktion af skjoldbruskkirtlen (diffus giftig struma, endemisk struma).
Ved godt:
1. Moderne nomenklatur og klassificering af hormoner.
2. De vigtigste stadier af transmissionen af hormonelle signaler ind i cellen.
3. Stadier af syntese og sekretion af insulin og de vigtigste kontra-insulære hormoner.
4. Mekanismer til at opretholde koncentrationen af de vigtigste energibærere i blodet
kalve med en normal ernæringsrytme.
Emne 11.1. HOMONERNES ROLLE I REGULERING AF STÆRKNING AF METABOLISME
1. For en flercellet organismes normale funktion er forholdet mellem individuelle celler, væv og organer nødvendigt. Dette forhold udføres:
nervesystem(central og perifer) gennem nerveimpulser og neurotransmittere;
endokrine system gennem de endokrine kirtler og hormoner, som syntetiseres af specialiserede celler i disse kirtler, frigives til blodet og transporteres til forskellige organer og væv;
parakrine og autokrin systemer gennem forskellige forbindelser, der udskilles i det intercellulære rum og interagerer med receptorer fra enten nærliggende celler eller den samme celle (prostaglandiner, hormoner i mave-tarmkanalen, histamin osv.);
immunsystemet gennem specifikke proteiner (cytokiner, antistoffer).
2. Endokrine system sikrer regulering og integration af metabolisme i forskellige væv som reaktion på ændringer i betingelserne i det ydre og indre miljø. Hormoner fungerer som kemiske budbringere, der bærer information om disse ændringer til forskellige organer og væv. En celles reaktion på et hormons virkning bestemmes både af hormonets kemiske struktur og af den celletype, som dets virkning er rettet mod. Hormoner er til stede i blodet i meget lave koncentrationer, og deres virkning er normalt kortvarig.
Dette skyldes for det første reguleringen af deres syntese og sekretion og for det andet den høje hastighed af inaktivering af cirkulerende hormoner. De vigtigste forbindelser mellem nerve- og endokrine reguleringssystemer udføres ved hjælp af specielle dele af hjernen - hypothalamus og hypofysen. Systemet med neurohumoral regulering har sit eget hierarki, hvis spids er CNS og streng rækkefølge af processer.
3. Hierarki af reguleringssystemer. Systemerne til regulering af stofskifte og kropsfunktioner danner tre hierarkiske niveauer (fig. 11.1).
Første niveau- centralnervesystemet. Nerveceller modtager signaler fra det ydre og indre miljø, omdanner dem til form af en nerveimpuls, som i synapsen forårsager frigivelsen af mediatoren. Mediatorer forårsager metaboliske ændringer i effektorceller gennem intracellulære reguleringsmekanismer.
Andet niveau- endokrine system- omfatter hypothalamus, hypofysen, perifere endokrine kirtler samt specialiserede celler i nogle organer og væv (mave-tarmkanalen, adipocytter), som syntetiserer hormoner og frigiver dem til blodet under påvirkning af en passende stimulus.
Tredje niveau- intracellulært- udgør ændringer i stofskiftet i en celle eller en bestemt metabolisk vej som følge af:
Ændringer aktivitet enzymer ved aktivering eller inhibering;
Ændringer mængder enzymer ved mekanismen til induktion eller undertrykkelse af proteinsyntese eller ændringer i hastigheden af deres nedbrydning;
Ændringer transporthastighed stoffer på tværs af cellemembraner. Syntese og udskillelse af hormoner stimuleret af ydre og indre
signaler til CNS. Disse signaler via nerveforbindelser kommer ind i hypothalamus, hvor de stimulerer syntesen af peptidhormoner (de såkaldte frigivende hormoner) - liberiner og statiner. Liberianere og statiner transporteres til den forreste hypofyse, hvor de stimulerer eller hæmmer syntesen af tropiske hormoner. Tropiske hormoner i hypofysen stimulerer syntesen og udskillelsen af hormoner fra de perifere endokrine kirtler, som kommer ind i det generelle kredsløb. Nogle hypothalamushormoner lagres i den bageste hypofyse, hvorfra de udskilles til blodet (vasopressin, oxytocin).
 En ændring i koncentrationen af metabolitter i målceller ved en negativ feedback-mekanisme undertrykker syntesen af hormoner, der virker enten på de endokrine kirtler eller på hypothalamus; syntesen og udskillelsen af tropiske hormoner undertrykkes af de perifere kirtlers hormoner.
En ændring i koncentrationen af metabolitter i målceller ved en negativ feedback-mekanisme undertrykker syntesen af hormoner, der virker enten på de endokrine kirtler eller på hypothalamus; syntesen og udskillelsen af tropiske hormoner undertrykkes af de perifere kirtlers hormoner.
Emne 11.2. MEKANISMER TIL TRANSMISSION AF HORMONALE SIGNALER TIL CELLER
Den biologiske virkning af hormoner manifesteret gennem deres interaktion med celler, der har receptorer for dette hormon (målceller). For at biologisk aktivitet kan være aktiv, skal bindingen af et hormon til en receptor resultere i et kemisk signal i cellen, der fremkalder et specifikt biologisk respons, såsom en ændring i syntesehastigheden af enzymer og andre proteiner eller en ændring i deres aktivitet (se modul 4). Målet for hormonet kan tjene som celler i et eller flere væv. Hormonet påvirker målcellen og forårsager et specifikt respons, hvis manifestation afhænger af, hvilke metaboliske veje der aktiveres eller hæmmes i denne celle. For eksempel er skjoldbruskkirtlen et specifikt mål for thyrotropin, som øger antallet af acinære skjoldbruskkirtelceller og øger hastigheden af biosyntese af skjoldbruskkirtelhormoner. Glukagon, der virker på adipocytter, aktiverer lipolyse, stimulerer glykogenmobilisering og glukoneogenese i leveren.
Receptorer hormoner kan være placeret enten i plasmamembranen eller inde i cellen (i cytosolen eller kernen).
I henhold til virkningsmekanismen Hormoner kan opdeles i to grupper:
Til først Denne gruppe omfatter hormoner, der interagerer med membranreceptorer(peptidhormoner, adrenalin såvel som hormoner af lokal virkning - cytokiner, eicosanoider);
- sekund gruppe omfatter hormoner, der interagerer med intracellulære receptorer- steroidhormoner, thyroxin (se modul 4).
Binding af et hormon (primær budbringer) til receptoren fører til en ændring i receptorens konformation. Disse ændringer fanges af andre makromolekyler, dvs. bindingen af hormonet til receptoren fører til parring af nogle molekyler med andre (signaltransduktion). Der genereres således et signal, der regulerer det cellulære respons. Afhængigt af metoden til transmission af det hormonelle signal ændres hastigheden af metaboliske reaktioner i celler:
Som et resultat af ændringer i aktiviteten af enzymer;
Som følge af en ændring i antallet af enzymer (fig. 11.2).
 Ris. 11.2. De vigtigste trin i transmissionen af hormonelle signaler til målceller
Ris. 11.2. De vigtigste trin i transmissionen af hormonelle signaler til målceller
Emne 11.3. STRUKTUR OG BIOSYNTESE AF HORMONER
1. Peptidhormoner syntetiseres, ligesom andre proteiner, i processen med translation fra aminosyrer. Nogle peptidhormoner er korte peptider; for eksempel hypothalamushormonet thyrotropin - liberin - tripeptid. De fleste hypofyseforreste hormoner er glykoproteiner.
Nogle peptidhormoner er produkter af et fælles gen (fig. 11.3). De fleste polypeptidhormoner syntetiseres som inaktive prækursorer - præprohormoner. Dannelsen af aktive hormoner sker ved delvis proteolyse.
2. Insulin- et polypeptid bestående af to polypeptidkæder. Kæde A indeholder 21 aminosyrerester, kæde B - 30 aminosyrerester. Begge kæder er forbundet med to disulfidbroer. Insulinmolekylet indeholder også en intramolekylær disulfidbro i A-kæden.
biosyntese af insulin Det begynder med dannelsen af inaktive prækursorer, preproinsulin og proinsulin, som som følge af sekventiel proteolyse omdannes til et aktivt hormon. Biosyntesen af preproinsulin begynder med dannelsen af et signalpeptid på polyribosomer forbundet med det endoplasmatiske reticulum. Signal
 Ris. 11.3. Dannelsen af peptidhormoner, der er produkter af et fælles gen:
Ris. 11.3. Dannelsen af peptidhormoner, der er produkter af et fælles gen:
A - POMC (proopiomelanocortin) syntetiseres i de forreste og mellemliggende lapper af hypofysen og i nogle andre væv (tarm, placenta). Polypeptidkæden består af 265 aminosyrerester; B - efter spaltning af det N-terminale signalpeptid opdeles polypeptidkæden i to fragmenter: ACTH (39 a.k.) og β-lipotropin (42-134 a.k.); C, D, E - med yderligere proteolyse sker dannelsen af α- og β-MSH (Melanocyt-stimulerende hormon) og endorfiner. CPPDH er et kortikotropin-lignende hormon i hypofysens mellemlap. POMC-behandling i hypofysens forreste og mellemliggende lapper forløber forskelligt med dannelsen af et andet sæt peptider.
peptidet trænger ind i lumen af det endoplasmatiske reticulum og leder den voksende polypeptidkæde ind i ER. Efter at syntesen af preproinsulin er afsluttet, spaltes signalpeptidet fra (fig. 11.4).
Proinsulin (86 aminosyrerester) kommer ind i Golgi-apparatet, hvor det under påvirkning af specifikke proteaser spaltes på flere steder for at danne insulin (51 aminosyrerester) og et C-peptid bestående af 31 aminosyrerester. Insulin og C-peptid er inkorporeret i sekretoriske granulat i ækvimolære mængder. I granulat kombineres insulin med zink for at danne dimerer og hexamerer. Modne granula smelter sammen med plasmamembranen, og insulin og C-peptid udskilles i den ekstracellulære væske ved exocytose. Efter sekretion i blodet nedbrydes insulinoligomerer. Halveringstiden for insulin i plasma er 3-10 minutter, C-peptid - omkring 30 minutter. Nedbrydning af insulin sker under påvirkning af enzymet insulinase hovedsageligt i leveren og i mindre grad i nyrerne.
Den vigtigste stimulator for insulinsyntese og -sekretion er glucose. Insulinsekretion forstærkes også af visse aminosyrer (især arginin og lysin), ketonstoffer og fedtsyrer. Adrenalin, somatostatin og nogle gastrointestinale peptider hæmmer insulinsekretion.
 Ris. 11.4. Skema for insulinbiosyntese i bugspytkirtelceller:
Ris. 11.4. Skema for insulinbiosyntese i bugspytkirtelceller:
1 - syntese af polypeptidkæden af proinsulin; 2 - syntese sker på polyribosomer fastgjort til den ydre overflade af ER-membranen; 3 - signalpeptidet spaltes fra ved afslutning af syntesen af polypeptidkæden, og proinsulin dannes; 4 - proinsulin transporteres fra ER til Golgi-apparatet og spaltes til insulin og C-peptid; 5 - insulin og C-peptid inkorporeres i sekretoriske granula og frigives ved exocytose (6); ER - endoplasmatisk retikulum; N er den terminale del af molekylet;
3. Glukagon- enkeltkædet polypeptid, bestående af 29 aminosyrerester. Biosyntese af glukagon sker i α-cellerne i Langerhans-øerne fra en inaktiv forløber for præproglucagon, som som følge af delvis proteolyse omdannes til et aktivt hormon. Glucose og insulin undertrykker glukagonsekretion; mange forbindelser, herunder aminosyrer, fedtsyrer, neurotransmittere (adrenalin), stimulerer det. Halveringstiden for hormonet er ~5 minutter. I leveren nedbrydes glukagon hurtigt af specifikke proteaser.
4. Somatotropin syntetiseres som et prohormon i somatotrofe celler, som er mest talrige i den forreste hypofyse. Væksthormon i alle pattedyrarter er en enkeltkæde
et peptid med en molekylvægt på 22 kDa bestående af 191 aminosyrerester og med to intramolekylære disulfidbindinger. Væksthormonsekretion er pulserende med intervaller på 20-30 minutter. En af de største toppe bemærkes kort efter at være faldet i søvn. Under påvirkning af forskellige stimuli (motion, faste, proteinfødevarer, aminosyren arginin), selv hos ikke-voksende voksne, kan niveauet af væksthormon i blodet stige til 30-100 ng / ml. Reguleringen af syntesen og udskillelsen af væksthormon udføres af mange faktorer. Den primære stimulerende effekt udøves af somatoliberin, den vigtigste hæmmende effekt er hypothalamus somatostatin.
5. Jodthyroniner syntetiseret som en del af et protein - thyroglobulin (Tg)
 Ris. 11.5. Syntese af iodthyroniner:
Ris. 11.5. Syntese af iodthyroniner:
ER - endoplasmatisk retikulum; DIT - diiodthyronin; Tg - thyroglobulin; T 3 - triiodothyronin, T 4 - thyroxin. Thyroglobulin syntetiseres på ribosomer, kommer derefter ind i Golgi-komplekset og derefter ind i det ekstracellulære kolloid, hvor det opbevares, og hvor tyrosinrester ioderes. Dannelsen af jodthyroniner sker i flere stadier: transport af jod ind i skjoldbruskkirtlens celler, oxidation af jod, jodering af tyrosinrester, dannelse af jodthyroniner, transport af jodthyroniner til blodet
thyroglobulin- glykoprotein, indeholder 115 tyrosinrester, syntetiseres i den basale del af cellen og lagres i det ekstracellulære kolloid, hvor tyrosinrester ioderes og iodthyroniner dannes.
Under indflydelse thyroperoxidase oxideret jod reagerer med tyrosinrester og danner monoiodothyroniner (MIT) og diiodothyroniner (DIT). To DIT-molekyler kondenserer til dannelse af T 4, og MIT og DIT kondenserer til dannelse af T 3 . Jodthyroglobulin transporteres ind i cellen ved endocytose og hydrolyseres af lysosomenzymer med frigivelse af T 3 og T 4 (fig. 11.6).
 Ris. 11.6. Struktur af skjoldbruskkirtelhormoner
Ris. 11.6. Struktur af skjoldbruskkirtelhormoner
T3 er den biologisk aktive hovedform af iodthyroniner; dens affinitet til målcellereceptoren er 10 gange højere end for T4. I perifere væv dannes den såkaldte "omvendte" form af T 3, som et resultat af deiodering af T 4-delen ved det femte carbonatom, som næsten er fuldstændig blottet for biologisk aktivitet
I blodet er iodthyroniner i bundet form i et kompleks med thyroxinbindende protein. Kun 0,03 % T 4 og 0,3 % T 3 er i fri tilstand. Den biologiske aktivitet af iodthyroniner skyldes den ubundne fraktion. Transportproteiner fungerer som en slags depot, som kan give en ekstra mængde frie hormoner. Syntese og sekretion af iodthyroniner reguleres af hypothalamus-hypofysesystemet
 Ris. 11.7. Regulering af syntese og sekretion af iodthyroniner:
Ris. 11.7. Regulering af syntese og sekretion af iodthyroniner:
1 - thyrotropin-liberin stimulerer frigivelsen af TSH; 2 - TSH stimulerer syntesen og sekretionen af iodthyroniner; 3, 4 - iodthyroniner hæmmer syntesen og udskillelsen af TSH
Iodthyroniner regulerer to typer processer:
Vækst og differentiering af væv;
Energiudveksling.
6. Kortikosteroider. Den fælles forløber for alle kortikosteroider er kolesterol. Kilden til kolesterol til syntese af kortikosteroider er dets estere, som kommer ind i cellen som en del af LDL eller aflejres i cellen. Frigivelsen af kolesterol fra dets estere og syntesen af kortikosteroider stimuleres af corticotropin. Kortisolsyntesereaktioner forekommer i forskellige kompartmenter af cellerne i binyrebarken (se fig. 11.12). Under syntesen af kortikosteroider dannes mere end 40 metabolitter, der adskiller sig i struktur og biologisk aktivitet. De vigtigste kortikosteroider med udtalt hormonel aktivitet er cortisol, hovedrepræsentanten for glukokortikoidgruppen, aldosteron, det vigtigste mineralokortikoid og androgener.
I det første trin af syntesen af kortikosteroider omdannes kolesterol til pregnenolon ved at spalte 6-carbon-fragmentet fra sidekæden af kolesterol og oxidere carbonatomet C20. Pregnenolon omdannes til progesteron - C 21 forløber for steroider - cortisol og aldosteron - og C 19 steroider - forløbere for androgener. Hvilken slags steroid, der bliver slutproduktet, afhænger af sættet af enzymer i cellen og rækkefølgen af hydroxyleringsreaktioner (fig. 11.8).
 Ris. 11.8. Syntese af større kortikosteroider:
Ris. 11.8. Syntese af større kortikosteroider:
1 - omdannelse af kolesterol til pregnenolon; 2 - dannelsen af progesteron;
3-hydroxylering af progesteron (17-21-11) og dannelsen af cortisol;
4 - hydroxylering af progesteron (21-11) og dannelse af aldosteron;
5 - androgensyntesevej
Primær hydroxylering af progesteron med 17-hydroxylase og derefter med 21- og 11-hydroxylase fører til syntese af cortisol. Aldosterondannelsesreaktioner involverer hydroxylering af progesteron først med 21-hydroxylase og derefter med 11-hydroxylase (se fig. 11.8). Hastigheden af syntese og sekretion af kortisol reguleres af hypothalamus-hypofysesystemet af en negativ feedback-mekanisme (fig. 11.9).
Steroidhormoner transporteres af blodet i kombination med specifikke transportproteiner.
katabolisme hormoner i binyrebarken forekommer primært i leveren. Reaktionerne af hydroxylering, oxidation og
 Ris. 11.9. Regulering af syntese og sekretion af kortisol:
Ris. 11.9. Regulering af syntese og sekretion af kortisol:
1 - stimulering af syntesen af corticotropin-liberin; 2 - corticotropinliberin stimulerer syntesen og sekretionen af ACTH; 3 - ACTH stimulerer syntesen og udskillelsen af cortisol; 4 - kortisol hæmmer udskillelsen af ACTH og corticoliberin
hormongendannelse. Katabolismeprodukterne af kortikosteroider (undtagen kortikosteron og aldosteron) udskilles i urinen i form af 17-ketosteroider. Disse metaboliske produkter udskilles hovedsageligt i form af konjugater med glucuron- og svovlsyre. Hos mænd dannes 2/3 af ketosteroider på grund af kortikosteroider og 1/3 på grund af testosteron (kun 12-17 mg pr. dag). Hos kvinder dannes 17-ketosteroider hovedsageligt på grund af kortikosteroider (7-12 mg pr. dag).
Emne 11.4. REGULERING AF UDVEKSLING AF BASISKE ENERGIBÆRERE I NORMAL RYTME
MAD
1. Energiværdien af de vigtigste næringsstoffer er udtrykt i kilokalorier og er: for kulhydrater - 4 kcal / g, for fedt - 9 kcal / g, for proteiner - 4 kcal / g. En voksen rask person har brug for 2000-3000 kcal (8000-12000 kJ) energi om dagen.
Med den sædvanlige ernæringsrytme er intervallerne mellem måltiderne 4-5 timer med en 8-12 timers nattepause. under fordøjelsen og absorptionsperiode(2-4 timer) kan de vigtigste energibærere, der bruges af væv (glukose, fedtsyrer, aminosyrer), komme ind i blodet direkte fra fordøjelseskanalen. PÅ postabsorberende periode(tiden efter fordøjelsen er afsluttet indtil næste måltid) og under sult dannes energisubstrater
i processen med katabolisme af deponerede energibærere. Hovedrollen i reguleringen af disse processer spilles af insulin og glukagon. Insulinantagonister er også adrenalin, kortisol, iodthyroniner og somatotropin
(de såkaldte kontrainsulære hormoner).
Insulin og kontrainsulære hormoner giver en balance mellem kroppens behov og evner til at opnå den energi, der er nødvendig for normal funktion og vækst. Denne balance er defineret som energi homeostase. Med en normal spiserytme holdes koncentrationen af glukose i blodet på niveauet 65-110 mg / dl (3,58-6,05 mmol / l) på grund af påvirkningen af to hovedhormoner - insulin og glucagon. Insulin og glucagon er de vigtigste regulatorer af metabolisme under de skiftende fordøjelsestilstande, postabsorptive periode og sult. Fordøjelsesperioderne udgør 10-15 timer i døgnet, og energiforbruget sker inden for 24 timer. Derfor lagres en del af energibærerne under fordøjelsen til brug i den postabsorberende periode.
Leveren, fedtvævet og musklerne er de vigtigste organer, der giver metaboliske ændringer i overensstemmelse med ernæringens rytme. Opbevaringstilstanden aktiveres efter et måltid og erstattes af tilstanden til mobilisering af reserver efter afslutningen af absorptionsperioden.
2. Ændringer i metabolismen af de vigtigste energibærere i absorptionsperioden primært på grund af høj insulin-glucagon indeks
(Fig. 11.10).
I leveren stiger glukoseforbruget, hvilket er en konsekvens af accelerationen af metaboliske veje, hvor glukose omdannes til aflejrede former for energibærere: glykogen og fedtstoffer.
Med en stigning i koncentrationen af glucose i hepatocytter aktiveres glucokinase, som omdanner glucose til glucose-6-phosphat. Derudover inducerer insulin syntesen af glucokinase mRNA. Som et resultat stiger koncentrationen af glucose-6-phosphat i hepatocytter, hvilket forårsager en acceleration glykogen syntese. Dette lettes også af den samtidige inaktivering af glykogenphosphorylase og aktivering af glykogensyntase. Påvirket af insulin i hepatocytter accelererer glykolysen som følge af en stigning i aktiviteten og antallet af nøgleenzymer: glucokinase, phosphofructokinase og pyruvatkinase. Samtidig hæmmes gluconeogenesen som et resultat af inaktivering af fructose-1,6-bisphosphatase og insulinrepression af syntesen af phosphoenolpyruvat carboxykinase, gluconeogenesens nøgleenzymer (se modul 6).
En stigning i koncentrationen af glucose-6-phosphat i hepatocytter i absorptionsperioden kombineres med den aktive brug af NADPH til syntese af fedtsyrer, hvilket bidrager til stimuleringen pentosefosfatvejen.
Acceleration af fedtsyresyntese Det sikres ved tilgængeligheden af substrater (acetyl-CoA og NADPH) dannet under glukosemetabolisme, samt ved aktivering og induktion af nøgleenzymer til syntese af fedtsyrer med insulin.
 Ris. 11.10. Måder at bruge de vigtigste energibærere i den absorberende periode:
Ris. 11.10. Måder at bruge de vigtigste energibærere i den absorberende periode:
1 - biosyntese af glykogen i leveren; 2 - glykolyse; 3 - TAG-biosyntese i leveren; 4 - TAG-biosyntese i fedtvæv; 5 - glykogenbiosyntese i muskler; 6 - proteinbiosyntese i forskellige væv, herunder leveren; FA - fedtsyrer
Aminosyrer, der kommer ind i leveren fra fordøjelseskanalen, bruges til at syntetisere proteiner og andre nitrogenholdige forbindelser, og deres overskud kommer enten ind i blodbanen og transporteres til andre væv eller deamineres, efterfulgt af inklusion af nitrogenfrie rester i den generelle katabolismevej (se modul 9).
Metaboliske ændringer i adipocytter. Hovedfunktionen af fedtvæv er lagring af energibærere i form triacylglyceroler. glukose transport ind i adipocytter. En stigning i intracellulær glucosekoncentration og aktivering af nøgleenzymer i glykolyse giver dannelsen af acetyl-CoA og glycerol-3-phosphat, som er nødvendige for syntesen af TAG. Stimulering af pentosephosphatvejen giver dannelsen af NADPH, som er nødvendig for syntesen af fedtsyrer. De novo-fedtsyrebiosyntese i humant fedtvæv forløber dog kun med høj hastighed efter forudgående faste. Under en normal fodringsrytme er TAG-syntese hovedsageligt baseret på fedtsyrer, der kommer fra chylomikroner og VLDL under påvirkning af Lp-lipase (se modul 8).
Da den hormonfølsomme TAG-lipase i den absorberende tilstand er i en dephosphoryleret, inaktiv form, hæmmes lipolyseprocessen.
Ændringer i muskelstofskiftet. Under påvirkning af insulin accelererer glukose transport ind i muskelceller. Glucose phosphoryleres og oxideres for at give energi til celler og bruges også til at syntetisere glykogen. Fedtsyrer, der kommer fra chylomikroner og VLDL i denne periode, spiller en ubetydelig rolle i muskelenergistofskiftet. Tilstrømningen af aminosyrer ind i musklerne og proteinbiosyntesen øges også under påvirkning af insulin, især efter indtagelse af proteinmåltider og under muskelarbejde.
3. Ændringer i metabolismen af de vigtigste energibærere, når den absorberende tilstand ændres til postabsorptiv. I den postabsorptive periode, med et fald i insulin-glucagon-indekset, er ændringer i metabolisme hovedsageligt rettet mod at opretholde koncentrationen af glukose i blodet, som tjener som hovedenergisubstratet for hjernen og den eneste energikilde for erytrocytter. De vigtigste ændringer i stofskiftet i denne periode sker i leveren og fedtvævet (fig. 11.11) og har til formål at genopbygge glukose fra interne reserver og bruge andre energisubstrater (fedtstoffer og aminosyrer).
Metaboliske ændringer i leveren. Under påvirkning af glukagon accelererer glykogen mobilisering(se modul 6). Leverglykogenlagrene er opbrugt i løbet af en 18-24 timers faste. Den vigtigste kilde til glukose, når glykogenlagrene er opbrugt, bliver glukoneogenese, som begynder at accelerere 4-6 timer efter sidste måltid. Substrater til glucosesyntese er laktat, glycerol og aminosyrer. Fedtsyresyntesehastigheden falder på grund af phosphorylering og inaktivering af acetyl-CoA carboxylase under phosphorylering, og hastigheden af β-oxidation stiger. Samtidig øges tilførslen af fedtsyrer til leveren, som transporteres fra fedtdepoter som følge af accelereret lipolyse. Acetyl-CoA, dannet under oxidation af fedtsyrer, bruges i leveren til syntese af ketonstoffer.
i fedtvæv med TAG-syntesehastigheden falder, og lipolyse stimuleres. Stimulering af lipolyse er resultatet af aktivering af den hormonfølsomme adipocyt TAG-lipase under påvirkning af glucagon. Fedtsyrer bliver vigtige energikilder i leveren, musklerne og fedtvævet.
I den postabsorptive periode holdes koncentrationen af glukose i blodet på niveauet 60-100 mg / dl (3,5-5,5 mmol / l), og niveauet af fedtsyrer og ketonstoffer stiger.
 Ris. 11.11. Måder at bruge de vigtigste energibærere, når du skifter fra en absorberende tilstand til en post-absorberende tilstand:
Ris. 11.11. Måder at bruge de vigtigste energibærere, når du skifter fra en absorberende tilstand til en post-absorberende tilstand:
I - fald i insulin-glucagon indeks; 2 - nedbrydning af glykogen; 3, 4 - transport af glucose til hjernen og erytrocytter; 5 - katabolisme af fedtstoffer; 6 - transport af fedt til leveren og musklerne; 7 - syntese af ketonstoffer i leveren; 8 - transport af ketonlegemer til musklerne; 9 - gluconeogenese fra aminosyrer; 10 - syntese og udskillelse af urinstof;
II - laktattransport til leveren og inklusion i gluconeogenese; 12 - gluconeogenese fra glycerol; KT - ketonlegemer; FA - fedtsyrer
Emne 11.5. ÆNDRINGER I METABOLISME UNDER HYPO- OG HYPERSEKRERING AF HORMONER
En ændring i hastigheden af syntese og sekretion af hormoner kan ikke kun forekomme som en adaptiv proces, der opstår som reaktion på en ændring i kroppens fysiologiske aktivitet, men ofte som følge af krænkelser af de endokrine kirtlers funktionelle aktivitet under udviklingen af patologiske processer eller dysregulering i dem. Disse forstyrrelser kan vise sig enten i form hypofunktion, fører til et fald i mængden af hormonet, eller hyperfunktion, ledsaget af dets overdrevne syntese.
1. Hyperfunktion af skjoldbruskkirtlen(hyperthyroidisme) viser sig i flere kliniske former. Diffus giftig struma(Graves' sygdom, Graves' sygdom) er den mest almindelige sygdom i skjoldbruskkirtlen. Ved denne sygdom er der en stigning i størrelsen af skjoldbruskkirtlen (struma), en stigning i koncentrationen af iodthyroniner med 2-5 gange og udvikling af thyrotoksikose.
Karakteristiske tegn på thyrotoksikose er en stigning i basalt stofskifte, øget hjertefrekvens, muskelsvaghed, vægttab (på trods af øget appetit), svedtendens, feber, rysten og exophthalmos (svulmende øjne). Disse symptomer afspejler den samtidige stimulering af både anabolske (vækst og differentiering af væv) og kataboliske processer (katabolisme af kulhydrater, lipider og ryg) af iodthyroniner. I højere grad intensiveres katabolismeprocesserne, hvilket fremgår af en negativ nitrogenbalance. hyperthyroidisme kan opstå som følge af forskellige årsager: udvikling af en tumor, betændelse (thyroiditis), overdreven indtagelse af jod og jodholdige lægemidler, autoimmune reaktioner.
autoimmun hyperthyroidisme opstår som følge af dannelsen af antistoffer mod thyreoidea-stimulerende hormonreceptorer i skjoldbruskkirtlen. En af dem, immunoglobulin (IgG), efterligner virkningen af thyrotropin ved at interagere med TSH-receptorer på membranen af skjoldbruskkirtelceller. Dette fører til diffus overvækst af skjoldbruskkirtlen og overdreven ukontrolleret produktion af T 3 og T 4, fordi dannelsen af IgG ikke reguleres af feedback-mekanismen. Niveauet af TSH i denne sygdom er reduceret på grund af undertrykkelsen af hypofysens funktion ved høje koncentrationer af iodthyroniner.
2. Hypothyroidisme kan være resultatet af utilstrækkeligt indtag af jod i kroppen - endemisk struma. Mere sjældent opstår hypothyroidisme som følge af medfødte defekter i enzymer involveret i syntesen (for eksempel thyroperoxirase) af iodthyroniner, eller som en komplikation af andre sygdomme, hvor hypothalamus, hypofysen eller skjoldbruskkirtlen er beskadiget. I nogle former for hypothyroidisme findes antistoffer mod thyroglobulin i blodet. Hypofunktion af skjoldbruskkirtlen i den tidlige barndom fører til en forsinkelse i fysisk og mental udvikling - kretinisme. Hos voksne viser hypofunktion sig som myxødem(slimhindeødem). Den vigtigste manifestation af myxødem er overdreven ophobning af proteoglycaner og vand i huden. De vigtigste symptomer på hypothyroidisme: døsighed, nedsat tolerance over for kulde, vægtøgning, nedsat kropstemperatur.
3. Hypercortisolisme. Overskydende dannelse af kortikosteroider, hovedsageligt kortisol, - hyperkortisolisme- ofte resultatet af en krænkelse af de regulatoriske mekanismer for syntese af kortisol:
Med en hypofysetumor og øget produktion af corticotropin (Itsenko-Cushings sygdom);
Binyretumorer, der producerer kortisol (Itsenko-Cushings syndrom).
De vigtigste manifestationer af hyperkorticisme er hyperglucosemi og reduceret glukosetolerance på grund af stimulering af gluconeogenese og hypertension som et resultat af cortisols mineralocorticoid aktivitet og en stigning i koncentrationen af Na + ioner.
4. Hypokorticisme. Arvelig adrenogenital dystrofi i 95 % af tilfældene er det en konsekvens af en mangel på 21-hydroxylase (se fig. 11.8). Dette øger dannelsen af 17-OH progesteron og androgenproduktion. De karakteristiske symptomer på sygdommen er tidlig pubertet hos drenge og udviklingen af mandlige seksuelle karakteristika hos piger. Med delvis mangel på 21-hydroxylase hos kvinder kan menstruationscyklussen blive forstyrret.
Erhvervet binyrebarkinsufficiens kan udvikle sig som følge af tuberkuløs eller autoimmun skade på cellerne i binyrebarken og et fald i syntesen af kortikosteroider. Tab af regulatorisk kontrol fra binyrerne fører til øget sekretion af corticotropin. I disse tilfælde har patienterne øget pigmentering af hud og slimhinder. (Addisons sygdom) hvilket skyldes øget produktion af corticotropin og andre POMC-derivater, især melanocytstimulerende hormon (se fig. 11.3). De vigtigste kliniske manifestationer af binyrebarkinsufficiens: hypotension, muskelsvaghed, hyponatriæmi, vægttab, stressintolerance.
Insufficiens af funktion af binyrebarken ofte resultatet af langvarig brug af kortikosteroidlægemidler, der hæmmer syntesen af kortikotropin ved en feedbackmekanisme. Fraværet af stimulerende signaler fører til atrofi af cellerne i binyrebarken. Ved pludselig afbrydelse af hormonelle lægemidler kan der udvikles akut binyrebarkinsufficiens (det såkaldte "abstinenssyndrom"), som udgør en stor trussel mod livet, da det ledsages af dekompensation af alle typer stofskifte og tilpasningsprocesser. Det manifesteres ved vaskulær kollaps, alvorlig adynami, bevidsthedstab. Denne tilstand opstår på grund af en krænkelse af elektrolytmetabolismen, hvilket fører til tab af Na + og C1 - ioner i urinen og dehydrering på grund af tab af ekstracellulær væske. En ændring i kulhydratmetabolismen viser sig i et fald i blodsukkerniveauet, et fald i glykogenlagrene i leveren og skeletmuskulaturen.
1. Overfør til din notesbog og udfyld tabellen. 11.1.
Tabel 11.1. Insulin og de vigtigste kontrainsulære hormoner
2. Ved hjælp af fig. 11.4, nedskriv trinene i insulinsyntese. Forklar hvilke årsager der kan føre til udvikling af insulinmangel? Hvorfor er det muligt at bestemme koncentrationen af C-peptid i blodet i disse tilfælde med henblik på diagnosticering?
3. Undersøg skemaet for syntesen af iodthyroniner (fig. 11.5). Beskriv de vigtigste stadier af deres syntese og tegn et diagram over reguleringen af syntese og sekretion af skjoldbruskkirtelhormoner. Forklar de vigtigste manifestationer af hypo- og hyperthyroidisme. Hvorfor er det nødvendigt konstant at overvåge niveauet af TSH i blodet, når du bruger thyroxin som medicin?
4. Undersøg rækkefølgen af trin i syntesen af kortisol (fig. 11.8). Find på diagrammet de stadier, der katalyseres af enzymer, hvis defekt er årsagen til adrenogenital syndrom.
5. Beskriv skemaet for den intracellulære cyklus af cortisolsyntese, startende med interaktionen af ACTH med receptoren (fig. 11.12), og udskift tallene med navnene på de proteiner, der er involveret i dem.
6. Tegn et diagram over reguleringen af syntese og sekretion af kortikosteroider. Forklar årsagerne til og manifestationerne af steroidabstinenssyndrom.
7. Beskriv rækkefølgen af hændelser, der fører til en stigning i blodsukkeret i løbet af den første time efter et måltid og dens efterfølgende tilbagevenden til baseline inden for 2 timer (fig. 11.13). Forklar hormonernes rolle i disse begivenheder.
8. Analyser ændringer i hormonstatus og stofskifte i lever, fedtvæv og muskler i den absorberende (Fig. 11.10) og post-absorptive perioder (Fig. 11.11). Navngiv de processer, der er angivet med tal. Angiv de regulerende enzymer og mekanismen til at ændre deres aktivitet, idet der tages højde for, at det primære signal til stimulering af disse processer er en ændring i koncentrationen af glukose i blodet og gensidige ændringer i koncentrationen af insulin og glucagon (fig. 11.11).
 Ris. 11.12. Intracellulær cyklus af cortisolsyntese:
Ris. 11.12. Intracellulær cyklus af cortisolsyntese:
EHS - kolesterolestere; CS - kolesterol
OPGAVER TIL SELVKONTROL
1. Vælg de rigtige svar. Hormoner:
A. De manifesterer deres virkninger gennem interaktion med receptorer B. De syntetiseres i hypofysens bageste lap.
B. Ændring af enzymaktivitet ved delvis proteolyse D. Inducer enzymsyntese i målceller
D. Syntese og sekretion reguleres af en feedback-mekanisme
 Ris. 11.13. Dynamikken i ændringer i koncentrationen af glukose (A), insulin (B) og glukagon (C) efter at have spist et måltid rigt på kulhydrater
Ris. 11.13. Dynamikken i ændringer i koncentrationen af glukose (A), insulin (B) og glukagon (C) efter at have spist et måltid rigt på kulhydrater
2. Vælg det rigtige svar. Glukagon i fedtvæv aktiverer:
A. Hormonfølsom TAG-lipase B. Glucose-6-phosphat dehydrogenase
B. Acetyl-CoA-carboxylase D. LP-lipase
D. pyruvatkinase
3. Vælg det rigtige svar. Jodthyroniner:
A. Syntetiseret i hypofysen
B. Interagere med intracellulære receptorer
B. Stimuler arbejdet med Na, Ka-ATPase
D. I høje koncentrationer accelererer de katabolismeprocesserne D. Deltager i reaktionen på afkøling
4. Sæt match:
A. Graves' sygdom B. Myxedema
B. Endemisk struma D. Kretinisme
D. Autoimmun thyroiditis
1. Opstår med hypothyroidisme i en tidlig alder
2. Ledsaget af ophobning af proteoglykaner og vand i huden
3. Det er en konsekvens af dannelsen af immunglobulin, der efterligner virkningen af TSH
5. Vælg det rigtige svar.
Absorptionsperioden er karakteriseret ved:
A. Forøgelse af koncentrationen af insulin i blodet B. Fremskyndelse af syntesen af fedtstoffer i leveren
B. Acceleration af glukoneogenese
D. Acceleration af glykolyse i leveren
D. Forøgelse af koncentrationen af glukagon i blodet
6. Vælg det rigtige svar.
Under påvirkning af insulin i leveren accelerer:
A. Proteinbiosyntese
B. Biosyntese af glykogen
B. Gluconeogenese
D. Fedtsyrebiosyntese D. Glykolyse
7. Sæt en kamp. Hormon:
A. Insulin B. Glucagon
B. Kortisol D. Adrenalin
Fungere:
1. Stimulerer syntesen af fedt fra glukose i leveren
2. Stimulerer muskelglykogenmobilisering
3. Stimulerer syntesen af iodthyroniner
8. Vælg det rigtige svar. Steroide hormoner:
A. Trænge ind i målceller
B. Transporteres med blod i kombination med specifikke proteiner
B. Stimulerer
D. Interagere med kromatin og ændre transkriptionshastigheden D. Deltage i oversættelsesprocessen.
9. Vælg det rigtige svar. Insulin:
A. Fremskynder transporten af glukose til musklerne B. Fremskynder syntesen af glykogen i leveren
B. Stimulerer lipolyse i fedtvæv D. Accelererer glukoneogenesen
D. Accelererer transporten af glukose til adipocytter
1. A, G, D 6. A, B, D, D
2. MEN 7. 1-A, 2-D, 3-D
3. B, C, D, D 8. A, B, D
4. 1-D, 2-B, 3 - A 9. A, B, D
5. A, B, D
GRUNDLÆGGENDE VILKÅR OG KONCEPT
2. Præprohormon
3. Stimuli til syntese og sekretion
4. Målceller
5. Receptorer
6. Hierarki af reguleringssystemer
7. Autokrin virkningsmekanisme
8. Parakrin virkningsmekanisme
9. Homøostase
10. Absorptionsperiode
11. Postabsorptiv periode
12. Tilpasning
13. Hypofunktion
14. Hyperfunktion
15. Kontrinsulære hormoner
Løse problemer
1. Ved undersøgelse af patienter med symptomer på hypercortisolisme anvendes en funktionstest med en "belastning" af dexamethason (dexamethason er en strukturel analog af cortisol). Hvordan vil koncentrationen af 17-ketosteroider i urinen hos patienter ændre sig efter administration af dexamethason, hvis årsagen til hypercortisolisme er:
a) hyperproduktion af corticotropin;
b) hormonelt aktiv tumor i binyrerne.
2. Forældrene til en fem-årig pige tog til lægehuset til konsultation. Under undersøgelsen viste barnet manifestationer af sekundære mandlige seksuelle karakteristika: muskelhypertrofi, overdreven hårvækst og et fald i stemmens klang. Niveauet af ACTH i blodet øges. Lægen diagnosticerede adrenogenital syndrom (medfødt dysfunktion af binyrebarken). Begrund lægens diagnose. For det:
a) præsentere skemaet for syntese af steroidhormoner; navngiv de vigtigste fysiologisk aktive kortikosteroider og angiv deres funktioner;
b) navngiv de enzymer, hvis mangel er årsagen til de ovenfor beskrevne symptomer;
c) angive dannelsen af hvilke produkter af kortikosteroidsyntese, der øges i denne patologi;
d) Forklar hvorfor koncentrationen af ACTH i barnets blod øges.
3. En form for Addisons sygdom er en konsekvens af atrofi af cellerne i binyrebarken under langtidsbehandling med kortikosteroidlægemidler. De vigtigste manifestationer af sygdommen: muskelsvaghed, hypoglykæmi,
dystrofiske ændringer i musklerne, sænkning af blodtrykket; i nogle tilfælde har sådanne patienter øget pigmentering af hud og slimhinder. Hvordan forklarer man de anførte symptomer på sygdommen? Til forklaring:
a) præsentere skemaet for syntese af steroidhormoner; navngiv de vigtigste fysiologisk aktive kortikosteroider og angiv deres funktioner;
b) angive, hvilken kortikosteroidmangel, der er årsagen til hypoglykosæmi og muskeldystrofi ved denne sygdom;
c) Nævn årsagen til øget hudpigmentering ved Addisons sygdom.
4. Til patient N med hypothyroidisme ordinerede lægen behandling, herunder thyroxin. 3 måneder efter behandlingsstart faldt niveauet af TSH i blodet en smule. Hvorfor anbefalede lægen en stigning i dosis af thyroxin til denne patient? For et svar:
a) præsentere i form af et diagram mekanismen for regulering af syntesen og udskillelsen af skjoldbruskkirtelhormoner;
5. En 18-årig pige, der bor i en bjerglandsby, henvendte sig til en endokrinolog med klager over generel svaghed, nedsat kropstemperatur, forværret humør. Patienten blev henvist til en blodprøve for TSH og iodthyroniner. Resultaterne af analysen viste en stigning i koncentrationen af TSH og et fald i koncentrationen af T 4. . Forklare:
a) hvilken sygdom der kan antages hos patienten;
b) hvad kan være årsagen til en sådan patologi;
c) er der en sammenhæng mellem bopælen og forekomsten af denne sygdom;
d) hvilken diæt der skal overholdes for at forhindre denne patologi;
e) ordningen for regulering af syntesen af iodthyroniner og resultaterne af en blodprøve i emnet.
6. Til behandling af diffus toksisk struma anvendes thyreostatiske lægemidler af thionamidgruppen (thiamazol). Thionamiders virkningsmekanisme er, at når de kommer ind i skjoldbruskkirtlen, hæmmer de aktiviteten af thyroperoxidase. Forklar resultatet af thionamiders terapeutiske virkning. For det:
a) nævne de vigtigste årsager og kliniske manifestationer af thyrotoksikose;
b) give et skema for syntesen af iodthyroniner og angive de stadier, hvorpå stofferne virker;
c) angive, hvordan koncentrationen af iodthyroniner og TSH vil ændre sig som følge af behandlingen;
d) Beskriv ændringerne i stofskiftet under behandling med thionamider.
Modulopbygget enhed 2 BIOKEMISKE ÆNDRINGER I STOFFET UNDER FASTE OG DIABETES
Læringsmål At kunne:
1. Fortolk ændringer i omsætningen af kulhydrater, fedtstoffer og proteiner under sult og fysisk aktivitet som følge af virkningen af kontrainsulære hormoner.
2. Analyser de molekylære mekanismer for årsagerne til diabetes mellitus.
3. Forklar mekanismerne for indtræden af symptomer på diabetes mellitus som følge af ændringer i hastigheden af metaboliske processer.
4. Fortolk de vigtigste forskelle i stofskiftet ved faste og diabetes.
Ved godt:
1. Ændringer i hormonstatus under faste.
2. Ændring i udvekslingen af hovedenergibærere under sult.
3. Ændringer i hormonstatus og energistofskifte ved diabetes mellitus.
4. De vigtigste symptomer på diabetes mellitus og mekanismerne for deres forekomst.
5. Patogenese af akutte komplikationer ved diabetes.
6. Biokemisk grundlag for senkomplikationer af diabetes mellitus.
7. Tilgange til laboratoriediagnose af diabetes mellitus.
8. Molekylære mekanismer for principperne for diabetesbehandling og lovende behandlingsretninger.
Emne 11.6. ÆNDRINGER I hormonstatus og stofskifte under faste og fysisk arbejde
1. I den postabsorptive periode og faste falder niveauet af glukose i blodplasmaet til den nedre grænse af normen. Insulin-glukagon-forholdet er reduceret. Under disse forhold opstår en tilstand, som er karakteriseret ved overvægten af processerne med katabolisme af fedtstoffer, glykogen og proteiner på baggrund af et generelt fald i stofskiftet. Under påvirkning af kontrainsulære hormoner i denne periode sker der en udveksling af substrater mellem leveren, fedtvæv, muskler og hjerne. Denne udveksling tjener to formål:
Opretholdelse af koncentrationen af glucose i blodet på grund af gluconeogenese for at give glucoseafhængige væv (hjerne, røde blodlegemer);
Mobilisering af andre "brændstof"-molekyler, primært fedtstoffer, for at give energi til alt andet væv.
Manifestationen af disse ændringer giver os mulighed for betinget at skelne mellem tre faser af sult. På grund af skiftet af metabolisme til energimobiliseringstilstand, selv efter 5-6 ugers faste, er koncentrationen af glukose i blodet ikke mindre end 65 mg/dl. De væsentligste ændringer under faste sker i leveren, fedtvævet og musklerne (fig. 11.14).
2. Faser af sult. Sult det kan være kortvarigt - i løbet af dagen (første fase), vare i en uge (anden fase) eller flere uger (tredje fase).
PÅ første fase koncentrationen af insulin i blodet falder omkring 10-15 gange i forhold til fordøjelsesperioden, og koncentrationen af glucagon og kortisol stiger. Glykogenlagre er opbrugt, hastigheden af fedtmobilisering og hastigheden af gluconeogenese fra aminosyrer og glycerol stiger, koncentrationen af glukose i blodet falder til den nedre grænse af normen (60 mg / dl).
 Ris. 11.14. Ændringer i metabolismen af de vigtigste energibærere under faste:
Ris. 11.14. Ændringer i metabolismen af de vigtigste energibærere under faste:
1 - fald i insulin-glucogon-indekset; 2 - glykogenmobilisering; 3, 4 - GLA transport til hjernen og erytrocytter; 5 - TAG-mobilisering; 6 - FA transport til musklerne; 7 - syntese af ketonlegemer; 8 - transport af fedtsyrer i leveren; 9 - AA transport til leveren; 10 - gluconeogenese fra AA; 11 - laktattransport til leveren; 12 - transport af glycerol til leveren. Den stiplede linje angiver processerne, hvis hastighed falder
I anden fase mobilisering af fedt fortsætter, koncentrationen af fedtsyrer i blodet stiger, hastigheden af dannelsen af ketonstoffer i leveren og følgelig deres koncentration i blodet stiger; der lugter af acetone, som frigives med udåndingsluft og sved fra en sultende person. Glukoneogenesen fortsætter gennem nedbrydning af vævsproteiner.
PÅ tredje fase hastigheden af proteinnedbrydning og hastigheden af glukoneogenese fra aminosyrer falder. Stofskiftet sænkes. Kvælstofbalancen i alle faser af sult er negativ. Sammen med glukose bliver ketonlegemer en vigtig energikilde for hjernen.
3. Ændringer i metabolismen af de vigtigste energibærere under sult. Udveksling af kulhydrater. Kroppens glykogenlagre bliver opbrugt i løbet af en 24-timers faste. På grund af mobiliseringen af glykogen er der således kun sikret kortvarig sult. Gluconeogenese er den vigtigste proces, der forsyner væv med glukose under faste. Glukoneogenesen begynder at accelerere 4-6 timer efter det sidste måltid og bliver den eneste kilde til glukose under længere tids faste. De vigtigste substrater for gluconeogenese er aminosyrer, glycerol og laktat.
4. Metabolisme af fedtstoffer og ketonstoffer. Den vigtigste energikilde i de første dage af fasten er fedtsyrer, som dannes ud fra TAG'er i fedtvæv. Syntesen af ketonstoffer accelereres i leveren. Syntesen af ketonstoffer begynder i de første dage af fasten. Ketonlegemer bruges hovedsageligt i musklerne. Hjernens energibehov leveres også delvist af ketonstoffer. Efter 3 ugers faste falder oxidationshastigheden af ketonstoffer i musklerne, og musklerne bruger næsten udelukkende fedtsyrer. Koncentrationen af ketonstoffer i blodet stiger. Hjernens brug af ketonstoffer fortsætter, men bliver mindre aktiv på grund af et fald i hastigheden af gluconeogenese og et fald i glucosekoncentrationen.
5. Proteinstofskifte. I løbet af de første par dage af fasten nedbrydes muskelproteiner hurtigt - hovedkilden til substrater for glukoneogenese. Efter flere ugers faste falder hastigheden af glukoneogenese fra aminosyrer, hovedsageligt på grund af nedsat glukoseoptagelse og ketonlegemeudnyttelse i hjernen. Et fald i hastigheden af gluconeogenese fra aminosyrer er nødvendigt for at bevare proteiner, da tab af 1/3 af alle proteiner kan føre til døden. Varigheden af fasten afhænger af, hvor længe ketonstoffer kan syntetiseres og bruges. Dog kræves oxaloacetat og andre TCA-komponenter til oxidation af ketonstoffer. Normalt dannes de af glukose og aminosyrer, og under sult kun af aminosyrer.
Emne 11.7. ÆNDRINGER I HORMONAL STATUS OG METABOLISME HOS DIABETES MELLITUS
1. Diabetes på grund af relativ eller absolut mangel på insulin. Ifølge WHO-klassifikationen skelnes der mellem to hovedformer af sygdommen: type I diabetes - insulinafhængig (IDDM), og type II diabetes (INSD)- insulin uafhængig.
2. IDSD er en konsekvens af ødelæggelsen af β-celler i de Langerhanske øer som følge af autoimmune reaktioner. Type I diabetes kan være forårsaget af en virusinfektion, der ødelægger β-celler. Sådanne vira omfatter kopper, røde hunde, mæslinger, cytomegalovirus, fåresyge, Coxsackie-virus, adenovirus. IDDM står for cirka 25-30% af alle tilfælde af diabetes. Som regel sker ødelæggelsen af β-celler langsomt, og sygdommens begyndelse er ikke ledsaget af metaboliske forstyrrelser. Når 80-95 % af cellerne dør, opstår der en absolut mangel på insulin, og der udvikles alvorlige stofskifteforstyrrelser. IDDM påvirker de fleste børn, unge og unge voksne, men kan forekomme i alle aldre (fra et år).
3. NIDSD udvikler sig som et resultat af en krænkelse af omdannelsen af proinsulin til insulin, regulering af insulinsekretion, en stigning i insulinkatabolismehastigheden, beskadigelse af mekanismerne for transmission af insulinsignalet til målceller (f.eks. en defekt i insulinreceptor, beskadigelse af intracellulære mediatorer af insulinsignalet osv.), dannelsen af antistoffer mod insulinreceptorer og koncentrationen af insulin i blodet kan være normal eller endda forhøjet. De faktorer, der bestemmer udviklingen og det kliniske forløb af sygdommen, omfatter fedme, dårlig kost, stillesiddende livsstil og stress. NIDDM påvirker mennesker, normalt ældre end 40 år, udvikler sig gradvist, symptomerne er milde. Akutte komplikationer er sjældne.
4. Metaboliske ændringer i diabetes mellitus. Ved diabetes mellitus reduceres som regel forholdet mellem insulin og glukagon. Dette svækker stimuleringen af aflejringen af glykogen og fedtstoffer og øger mobiliseringen af energireserver. Lever, muskler og fedtvæv fungerer, selv efter at de har spist, i en post-absorberende tilstand.
5. Symptomer på diabetes. Hyperglucosemi. Alle former for diabetes er karakteriseret ved forhøjede niveauer af glukose i blodet. hyperglukosemi, både efter måltider og på tom mave, samt glucosuri. Efter et måltid kan glukosekoncentrationen nå op på 300-500 mg/dl og forbliver på et højt niveau i den post-absorberende periode, dvs. nedsat glukosetolerance.
Et fald i glucosetolerance observeres også i tilfælde af en latent (latent) form for diabetes mellitus. I disse tilfælde har folk ingen klager og kliniske symptomer, der er karakteristiske for diabetes mellitus, og koncentrationen af glukose i blodet på tom mave svarer til den øvre grænse for det normale. Imidlertid afslører brugen af provokerende tests (for eksempel en sukkerbelastning) et fald i glukosetolerance (fig. 11.15).
En stigning i koncentrationen af glucose i IDDM i blodplasma skyldes flere årsager. Med et fald i insulin-glucagon-indekset øges virkningerne af kontrainsulære hormoner, mængden af glucosebærerproteiner (GLUT-4) på membranerne af insulinafhængige celler (fedtvæv og muskler) falder. Følgelig reduceres disse cellers forbrug af glukose. I muskler og lever aflejres glukose ikke i form af glykogen; i fedtvæv falder hastigheden af syntese og aflejring af fedtstoffer. Desuden aktiverer virkningen af konrinsulære hormoner, primært glucagon, gluconeogenese fra aminosyrer, glycerol og laktat. En stigning i blodsukkerniveauet ved diabetes mellitus over nyrekoncentrationstærsklen på 180 mg/dL forårsager, at glukose udskilles i urinen.
Ketonæmi er et karakteristisk symptom på diabetes. Med et lavt forhold mellem insulin og glukagon deponeres fedtstoffer ikke, deres katabolisme accelereres, da den hormonfølsomme lipase i fedtvæv er i en fosforyleret aktiv form. Koncentrationen af ikke-esterificerede fedtsyrer i blodet stiger. Leveren optager fedtsyrer og oxiderer dem til acetyl-CoA, som igen
 Ris. 11.15. Ændringer i glukosetolerance hos patienter med latent diabetes mellitus.
Ris. 11.15. Ændringer i glukosetolerance hos patienter med latent diabetes mellitus.
Bestemmelsen af glukosetolerance bruges til at diagnosticere diabetes mellitus. Forsøgspersonen tager en glukoseopløsning med en hastighed på 1 g pr. 1 kg kropsvægt (sukkerbelastning). Koncentrationen af glukose i blodet måles inden for 2-3 timer med intervaller på 30 minutter. 1 - hos en rask person, 2 - hos en patient med diabetes mellitus
bliver til β-hydroxysmørsyre og acetoeddikesyre, hvilket resulterer i en stigning i koncentrationen af ketonstoffer i blodet - ketonemi. I væv er acetoacetat delvist decarboxyleret til acetone, hvis lugt kommer fra diabetespatienter og mærkes selv på afstand. En stigning i koncentrationen af ketonstoffer i blodet (over 20 mg/dl, nogle gange op til 100 mg/dl) fører til ketonuri. Ophobningen af ketonstoffer reducerer blodets bufferkapacitet og forårsager acidose (ketoacidose).
Hyperlipoproteinæmi. Diætfedt aflejres ikke i fedtvæv på grund af svækkelse af lagringsprocesser og lav aktivitet af Lp-lipase, men kommer ind i leveren, hvor de omdannes til triacylglyceroler, som transporteres fra leveren som en del af VLDL.
Azotæmi. Ved diabetes fører insulinmangel til et fald i syntesehastigheden og en stigning i nedbrydningen af proteiner i kroppen. Dette medfører en stigning i koncentrationen af aminosyrer i blodet. Aminosyrer kommer ind i leveren og deamineres. Nitrogenfri rester af glykogene aminosyrer er inkluderet i glukoneogenesen, hvilket yderligere forstærker hyperglykæmi. Den resulterende ammoniak kommer ind i ornithin-cyklussen, hvilket fører til en stigning i koncentrationen af urinstof i blodet og følgelig i urinen - azotæmi og azoturia.
Polyuri. Der kræves en stor mængde væske for at fjerne store mængder glukose, ketonstoffer og urinstof, hvilket kan resultere i dehydrering. Dette skyldes de særlige kendetegn ved nyrernes koncentrationsevne. For eksempel stiger urinproduktionen hos patienter flere gange og når i nogle tilfælde 8-9 liter om dagen, men overstiger oftere ikke 3-4 liter. Dette symptom kaldes polyuri. Tab af vand forårsager konstant tørst og øget vandindtag - polydipsi.
6. Akutte komplikationer af diabetes. Mekanismer for udvikling af diabetisk koma. Forstyrrelser i omsætningen af kulhydrater, fedtstoffer og proteiner ved diabetes mellitus kan føre til udvikling af koma (akutte komplikationer). Diabetisk koma manifesterer sig som en skarp krænkelse af alle kropsfunktioner, ledsaget af tab af bevidsthed. De vigtigste forløbere for diabetisk koma er acidose og vævsdehydrering (fig. 11.16).
Med dekompensation af diabetes udvikles en krænkelse af vand- og elektrolytmetabolismen. Årsagen til dette er hyperglucosemi, ledsaget af en stigning i osmotisk tryk i karlejet. For at opretholde osmolaritet begynder kompenserende bevægelse af væske fra celler og ekstracellulært rum ind i det vaskulære leje. Dette fører til vævstab af vand og elektrolytter, primært Na+, K+, Cl - , HCO 3 - ioner. Som følge heraf udvikles alvorlig cellulær dehydrering og mangel på intracellulære ioner (primært K+), ledsaget af generel dehydrering. Dette fører til et fald i perifer cirkulation, et fald i cerebral og renal blodgennemstrømning og hypoxi. Diabetisk koma udvikler sig langsomt over flere dage, men kan nogle gange
 Ris. 11.16. Metaboliske ændringer i diabetes mellitus og årsager til diabetisk koma
Ris. 11.16. Metaboliske ændringer i diabetes mellitus og årsager til diabetisk koma
ske inden for få timer. De første tegn kan være kvalme, opkastning, sløvhed. Arterielt tryk hos patienter reduceres.
Koma ved diabetes mellitus kan vise sig i tre hovedformer: ketoacidotisk, hyperosmolær og mælkesyreacidotisk.
Ketoacidotisk koma er karakteriseret ved svær insulinmangel, ketoacidose, polyuri og polydipsi. Hyperglukosæmi (20-30 mmol/l), forårsaget af insulinmangel, er ledsaget af store tab af væske og elektrolytter, dehydrering og plasmahyperosmolaritet. Den samlede koncentration af ketonstoffer når 100 mg / dl og derover.
På hyperosmolær i koma er ekstremt høje plasmaglukoseniveauer, polyuri, polydipsi og alvorlig dehydrering altid til stede. Det menes, at hyperglykosæmi hos de fleste patienter skyldes samtidig nedsat nyrefunktion. Serumketonstoffer påvises normalt ikke.
På mælkesyresyre i koma er hypotension, et fald i perifer cirkulation og vævshypoksi fremherskende, hvilket fører til et skift i stofskiftet mod anaerob glykolyse, som forårsager en stigning i koncentrationen af mælkesyre i blodet (mælkeacidose).
7. Senkomplikationer af diabetes er en konsekvens af langvarig hyperglykosæmi og fører ofte til tidlig invaliditet hos patienter. Hyperglucosemi fører til skader på blodkar og dysfunktion af forskellige væv og organer. En af hovedmekanismerne for vævsskade ved diabetes mellitus er glucosylering proteiner og den tilhørende dysfunktion af vævsceller, ændringer i blodets rheologiske egenskaber og hæmodynamik (fluiditet, viskositet).
Nogle forbindelser indeholder normalt kulhydratkomponenter (glykoproteiner, proteoglycaner, glykolipider). Syntesen af disse forbindelser sker som et resultat af enzymatiske reaktioner (enzymatisk glucosylering). Ikke-enzymatisk interaktion mellem aldehydgruppen af glucose med frie aminogrupper af proteiner (ikke-enzymatisk glucosylering) kan imidlertid også forekomme i menneskekroppen. I raske menneskers væv er denne proces langsom og accelererer i hyperglukosæmi.
Et af de første tegn på diabetes er en 2-3 gange stigning i glucosyleret hæmoglobin. Gennem hele erytrocytternes levetid trænger glucose frit gennem dens membran og binder sig irreversibelt til hæmoglobin, hovedsageligt af β-kæder uden deltagelse af enzymer. I dette tilfælde dannes en glucosyleret form af hæmoglobin HbA 1c. Denne form for hæmoglobin er til stede i små mængder hos raske mennesker. Ved tilstande med kronisk hyperglucosemi stiger procentdelen af HbA 1c i forhold til den samlede mængde hæmoglobin.
Graden af proteinglucosylering afhænger af hastigheden af deres fornyelse. I langsomt metaboliserende proteiner akkumuleres flere ændringer. Langsomt udveksling af proteiner omfatter proteiner fra det intercellulære
matrix, basalmembraner, øjets linse (krystalliner). Fortykkelse af basalmembranerne er et af de tidlige og permanente tegn på diabetes mellitus, manifesteret i form af diabetisk angiopati.
Ændringer manifesteret i et fald i arteriernes elasticitet, skader på store og mellemstore kar i hjernen, hjertet, underekstremiteterne, kaldes diabetiske makroangiopatier. De udvikler sig som et resultat af glucosylering af proteinerne i den intercellulære matrix - kollagen og elastin, hvilket fører til et fald i blodkarrenes elasticitet og nedsat blodcirkulation.
Resultatet af skader på kapillærer og små kar - m icroangiopati manifesterer sig i form af nefro- og retinopati. Årsagen til nogle sene komplikationer af diabetes mellitus (grå stær, retinopati) kan være en stigning i omdannelseshastigheden af glucose til sorbitol. Sorbitol anvendes ikke i andre metaboliske veje, og hastigheden af dets diffusion fra celler er lav. Hos patienter med diabetes mellitus ophobes sorbitol i nethinden og øjets linse, glomerulære celler i nyrerne, Schwann-celler og i endotelet. Sorbitol er giftigt for celler i høje koncentrationer. Dens ophobning i neuroner fører til en stigning i osmotisk tryk, cellehævelse og vævsødem. Opacificering af linsen, eller grå stær, kan udvikle sig både på grund af hævelse af linsen forårsaget af ophobning af sorbitol og forstyrrelse af den ordnede struktur af krystalliner, og på grund af glucosylering af krystalliner, som danner multimolekylære aggregater, der øger brydningsevnen af linsen.
OPGAVER TIL EKSTRA KURSARBEJDE
1. Overvej fig. 11.14, tegn diagrammer over processer, der accelereres i leveren og andre væv i den postabsorptive periode, skriv navnene på metaboliske veje og de tilsvarende regulatoriske enzymer ned.
2. Analyser de metaboliske ændringer vist i fig. 11.10 og 11.11 og sammenlign dem med ændringerne vist i fig. 11.14. For det:
a) nævne de processer, der aktiveres og hæmmes under længerevarende sult;
b) vælg og skriv skemaerne for processer, på grund af hvilke koncentrationen af glukose i blodet opretholdes under langvarig faste;
c) for hver udvalgt proces, angiv nøgleenzymer og
munke, under påvirkning af hvilke de aktiveres;
d) vælge og skrive skemaerne for processer, på grund af hvilke det udfører -
Xia energiforsyning af muskler under længerevarende sult.
3. Undersøg diagrammet over metaboliske ændringer ved diabetes mellitus (Fig. 11.16) Forklar årsagerne til hyperglukosæmi Skriv navnene på metaboliske veje, der accelereres under disse forhold.
4. Forklar årsagerne og mekanismerne for ketoacidose ved diabetes mellitus og tegn det tilsvarende diagram.
5. Sammenlign ændringer i hormonstatus og stofskifte ved diabetes og faste (fig. 11.14 og 11.16). Forklar hvorfor nedbrydningen af fedt og proteiner sker på baggrund af hyperglykæmi ved diabetes mellitus.
6. Nævn de vigtigste symptomer på diabetes. Begrund gyldigheden af udtrykket: "diabetes er sult midt i overflod." For det:
a) navngiv manifestationerne af diabetes mellitus, svarende til ændringer i stofskiftet under sult;
b) forklare årsagerne til disse ændringer;
c) Nævn de vigtigste forskelle i metabolisme ved diabetes mellitus og sult.
7. Fortsæt med at udfylde tabellen over senkomplikationer ved diabetes mellitus (tabel 11.2):
Tabel 11.2. Senkomplikationer af diabetes
OPGAVER TIL SELVKONTROL
1. Vælg det rigtige svar.
Ved faste:
A. Acetyl-CoA-carboxylase er phosphoryleret og aktiv B. Hormonfølsom TAG-lipase er inaktiv
B. Lp-lipase er aktiv i fedtvæv
D. Leverpyruvatkinase er phosphoryleret og aktiv E. cAMP-afhængig proteinkinase er aktiv i adipocytter
2. Vælg det rigtige svar. Med tre dages faste:
A. Insulin-glukagon-indekset er reduceret
B. Hastigheden af gluconeogenese fra aminosyrer stiger
B. Hastigheden af TAG-syntese i leveren falder D. Hastigheden af β-oxidation i leveren falder
D. Koncentrationen af ketonstoffer i blodet er over det normale
3. Vælg det rigtige svar.
En stigning i hastigheden af syntese af ketonstoffer under sult er en konsekvens af:
A. Reducerede glukagonniveauer
B. Nedsat dannelse af Acetyl-CoA i leveren
B. Forøgelse af koncentrationen af fedtsyrer i blodplasma D. Nedsættelse af β-oxidationshastigheden i leveren
E. Nedsat aktivitet af hormonfølsom TAG-lipase i adipocytter
4. Vælg det rigtige svar.
Ved diabetes mellitus, leveren:
A. Acceleration af glykogensyntese
B. Forøgelse af hastigheden af glukoneogenese
B. Nedsat hastighed af fedtsyntese
D. Forøgelse af hastigheden af acetoacetatsyntese
D. Øget aktivitet af acetyl-CoA carboxylase
5. Sæt match:
A. Højt insulinniveau B. Alkalose
B. Hypoglukosæmi
D. Høje kortisolniveauer
E. Autoimmun skade på β-celler
1. Kun med diabetes
2. Kun ved faste
3. Kun med steroid diabetes
6. Vælg det rigtige svar.
Med IDDM finder patienter oftest:
A. Hyperglucosemi
B. Høj hastighed af insulinkatabolisme
B. Koncentrationen af insulin i blodet er normal eller over normal D. Antistoffer mod pancreas β-celler
D. Mikroangiopati
7. Sæt match:
A. Makroangiopati B. Katarakt
B. Mikroangiopati D. Nefropati
D. Neuropati
1. Aktivering af sorbitol-vejen i Schwann-celler
2. Glucosylering af krystalliner
3. Fortykkelse af basalmembranerne i nyrernes glomeruli
STANDARDER FOR SVAR PÅ "OPGAVER TIL SELVKONTROL"
2. A, B, C, D
4. B, C, D
5. 1-D, 2-B, 3-G
6. A, G, D
7. 1-D, 2-B, 3-D
GRUNDLÆGGENDE VILKÅR OG KONCEPT
1. Faste
2. Fastefaser
3. Diabetes
6. Hyperglucosemi - glucosuri
7. Ketonæmi - ketonuri
8. Azotæmi - azoturia
9. Senkomplikationer af diabetes
10. Diabetisk koma
11. Ketoacidotisk koma
12. Hyperosmolær koma
13. Mælkesyre koma
14. Mikroangiopati
15. Makroangiopati
16. Neuropati
17. Nefropati
OPGAVER TIL AUDITIONELLT ARBEJDE
Løse problemer
1. Turister beregnede ikke fødevareforsyninger, og indtil de nåede den første bosættelse blev de tvunget til at sulte i 2 dage. Hvilke ændringer i stofskiftet vil forekomme hos disse turister? Til forklaring:
a) angiv, hvordan koncentrationen af glukose i turisternes blod vil ændre sig ved udgangen af den anden fastedag;
b) skriv skemaerne for processer, på grund af hvis aktivering en normal glukosekoncentration opretholdes på den første fastedag;
c) navngiv de hormoner, der regulerer niveauet af glukose i denne periode;
d) præsentere i form af et diagram virkningsmekanismen for disse hormoner;
e) angive de regulatoriske reaktioner af disse veje og måderne til deres aktivering.
2. Biokemiske undersøgelser af blod og urin hos en patient med type 1 diabetes mellitus viste:
Hvordan vil disse indikatorer ændre sig med en enkelt administration af en gennemsnitlig daglig dosis insulin til en patient? Som et resultat af aktiveringen af hvilke processer vil disse ændringer forekomme?
3. En patient kom til terapeuten med klager over progressiv svaghed, døsighed, svimmelhed. Symptomerne blev forværret af faste, hvilket fik lægen til at antage, at patienten havde hypoglykæmi. En blodprøve bekræftede antagelsen (glucoseniveau mindre end 2,5 mmol/l) og viste også et stærkt forhøjet niveau af C-peptid (mere end 800 pmol/l). Patienten lider ikke af diabetes og tager ikke sukkersænkende medicin. Hvilken sygdom kan man antage? Når du besvarer et spørgsmål:
a) navngiv de stimuli, der påvirker insulinudskillelsen;
b) beskrive insulins effekt på kulhydrat- og fedtstofskiftet i lever, fedtvæv og muskler;
c) forklare, hvorfor hypoglykosæmi er farlig, og hvilke processer i kroppen, der normalt forhindrer udviklingen af hypoglykosæmi, selv under sult;
d) navngiv sygdommen og foreslå en behandlingsmetode.
4. Patient N klagede over konstant sult, tørst, træthed og træthed. Bestemmelse af fastende glukosekoncentration viste 130 mg/dL. Hvilke yderligere undersøgelser for at fastslå diagnosen skal udføres i dette tilfælde? Hvilke resultater kan forudsiges, hvis type II diabetes opdages hos den undersøgte person?
5. En patient med diagnosen IDDM har ikke fået insulininjektioner i lang tid. Efter at patienten gik til lægen og en grundig undersøgelse, blev insulinbehandling ordineret. Efter 2 måneder viste bestemmelsen af fastende blodsukkerkoncentration 85 mg/dl, niveauet af glucosyleret hæmoglobin var 14% af det totale hæmoglobinniveau (normalt 5,8-7,2%).
Hvad er de mulige årsager til den høje koncentration af glucosyleret hæmoglobin hos denne patient på trods af igangværende behandling? Giv eksempler på glucosylering af andre proteiner. Forklar hvilke komplikationer dette kan føre til.
6. En 39-årig patient blev indlagt med klager over intens tørst, hurtig træthed. Vægttab i de sidste 5 uger var 4 kg trods god appetit og normal motion. En blodprøve viste, at koncentrationen af glukose 2 timer efter et måltid er 242 mg/dL. Hvilken sygdom kan antages hos denne patient? Hvad er årsagen til tørst? Hvordan forklarer man patientens hurtige træthed?
Modulær enhed 3 REGULERING AF VAND-SALT METABOLISME. ROLLE AF VASOPRESSIN, ALDOSTERON OG RENIN-ANGIOTENSIN SYSTEM. REGULERING AF CA 2 + OG FOSFAT METABOLISME
Læringsmål At kunne:
1. Analyser ændringer i stofskiftet, der opstår med nogle forstyrrelser i vand-saltmetabolismen (hyperaldosteronisme, renal hypertension).
2. Fortolke de molekylære mekanismer for forstyrrelser i syntesen og sekretionen af hormoner, der regulerer calciummetabolismen.
Ved godt:
1. Karakteristika for de vigtigste hormoner i WOS og stadierne af dens regulering.
2. De vigtigste funktioner af calcium i kroppen.
3. Mekanismer for hormonel regulering af udvekslingen af calcium- og fosfationer.
4. Manifestationer af nogle overtrædelser af syntesen og udskillelsen af hormoner, der regulerer udvekslingen af calcium og fosfater (hypo- og hyperparathyroidisme, rakitis).
Emne 11.8. REGULERING AF VAND-SALT METABOLISME
1. Hovedparametre vand-salt homeostase er osmotisk tryk, pH og volumen af intracellulær og ekstracellulær væske. Ændringer i disse parametre kan føre til ændringer i blodtryk, acidose eller alkalose, dehydrering og ødem. De vigtigste hormoner involveret i reguleringen af vand-saltbalancen er antidiuretisk hormon (ADH), aldosteron og atriel natriuretisk faktor (ANF).
2. Antidiuretisk hormon(ADH), eller vasopressin, er et peptid, der indeholder ni aminosyrer forbundet med en disulfidbro. Det syntetiseres som et prohormon i hypothalamus og overføres derefter til nerveenderne i den bageste hypofyse, hvorfra det udskilles i blodbanen med passende stimulering. Bevægelse langs axonet er forbundet med et specifikt bærerprotein (neurophysin) (fig. 11.17).
Den stimulus, der forårsager udskillelsen af ADH, er en stigning i koncentrationen af natriumioner og en stigning i det osmotiske tryk i den ekstracellulære væske.
De vigtigste målceller for ADH er cellerne i de distale tubuli og nyrernes opsamlingskanaler. Cellerne i disse kanaler er relativt uigennemtrængelige for vand, og i fravær af ADH er urinen ikke koncentreret og kan udskilles i mængder, der overstiger 20 liter om dagen (normalt 1-1,5 liter om dagen).
 Ris. 11.17. Sekretion og virkningsmekanisme af antidiuretisk hormon:
Ris. 11.17. Sekretion og virkningsmekanisme af antidiuretisk hormon:
A: 1 - supraoptisk neuron; 2 - paraventrikulær neuron; 3 - forreste lap af hypofysen; 4 - bageste lap af hypofysen; 5 - ADH-neurophysin; B: 1 - ADH binder til membranreceptoren V2, hvilket forårsager aktiveringen af adenylatcyclase (AC) og som et resultat dannelsen af cAMP; 2 - cAMP aktiverer proteinkinase, som phosphorylerer proteiner; 3 - phosphorylerede proteiner inducerer transkription af aquaporinproteingenet; 4 - aquaporin er indlejret i cellemembranen i nyretubuli
For ADH er der to typer receptorer - V 1 og V 2 . V2-receptor findes kun på overfladen af epitelceller i nyrerne. Bindingen af ADH til V 2 er forbundet med adenylatcyclasesystemet og stimulerer aktiveringen af proteinkinase (PKA), som phosphorylerer proteiner, der stimulerer ekspressionen af membranproteingenet, aquaporin-2. Aquaporin-2 bevæger sig til den apikale membran, integreres i den og danner vandkanaler, gennem hvilke vandmolekyler frit diffunderer ind i celler
nyretubuli og derefter ind i det interstitielle rum. Som følge heraf reabsorberes vand fra nyretubuli (se figur 11.17). Type V receptorer lokaliseret i glatte muskelmembraner. Interaktionen af ADH med V 1 receptoren fører til aktivering af phospholipase C, hvilket resulterer i frigivelse af Ca 2 + fra det endoplasmatiske retikulum og kontraktion af det vaskulære glatte muskellag.
3. Diabetes insipidus. ADH-mangel forårsaget af dysfunktion af den bageste hypofyse, samt en krænkelse af det hormonelle signaltransmissionssystem, kan føre til udviklingen diabetes insipidus. Den vigtigste manifestation af diabetes insipidus er polyuri, de der. udskillelse af store mængder lavdensitetsurin.
4. Aldosteron- det mest aktive mineralokortikosteroid - syntetiseres af cellerne i den glomerulære zone i binyrebarken fra kolesterol. Syntesen og sekretionen af aldosteron stimuleres af lav Na+-koncentration, høj K+-koncentration og renin-angiotensin-systemet. Hormonet trænger ind i cellerne i nyretubuli, interagerer med en specifik receptor, cytoplasmatisk eller nuklear (fig. 11.18), og inducerer syntesen af proteiner, der giver reabsorption af natriumioner og udskillelse af kaliumioner.
Derudover øger proteiner, hvis syntese er induceret af aldosteron, antallet af Na +, K + - ATPase-pumper og tjener også som enzymer af TCA, der genererer ATP-molekyler til aktiv iontransport. Det samlede resultat af virkningen af aldosteron er tilbageholdelse af NaCl i kroppen.
5. Hovedrollen i reguleringen af vand-saltbalancen, og dermed reguleringen af blodvolumen og blodtryk, spilles af systemet renin-angiotensinaldosteron(Fig. 11.19).
proteolytisk enzym renin syntetiseret af juxtaglomerulære celler i de renale afferente arterioler. Et fald i blodtrykket i de afferente arterioler, tab af væske eller blod og et fald i NaCl-koncentration stimulerer frigivelsen af renin. protein produceret i leveren angiotensinogen hydrolyseres af renin til dannelse af angiotensin I, som igen tjener som et substrat for ACE (angiotensin-konverterende enzym carboxydipentidyl peptidase). Et dipeptid spaltes fra angiotensin I for at danne angiotensin II. Gennem inositolfosfatsystemet ngiotensin II stimulerer syntesen og udskillelsen af aldosteron. Angiotensin II er også en kraftig vasokonstriktor og forårsager sammentrækning af de glatte muskelceller i blodkar, henholdsvis en stigning i blodtrykket og forårsager desuden tørst.
6. Renin-angiotensin-aldosteron-systemet giver genoprettelse af blodvolumen, som kan falde som følge af blødning, voldsom opkastning, diarré, svedtendens - tilstande, der er et signal for
 Ris. 11.18. Virkningsmekanismen af aldosteron.
Ris. 11.18. Virkningsmekanismen af aldosteron.
Aldosteron, der interagerer med intracellulære receptorer, stimulerer proteinsyntesen. Disse proteiner kan være:
1 - komponenter af natriumkanaler og øge reabsorptionen af Na + fra urin;
2 - TCA-enzymer, hvis aktivitet sikrer produktionen af ATP; 3 - Na +, K + - ATPase, en pumpe, der opretholder en lav intracellulær koncentration af natriumioner og en høj koncentration af kaliumioner
renin frigivelse. Dette lettes også af et fald i impulser fra baroreceptorerne i atrierne og arterierne som følge af et fald i det intravaskulære væskevolumen. Som følge heraf øges dannelsen af angiotensin II, og følgelig øges koncentrationen af aldosteron i blodet, hvilket forårsager en tilbageholdelse af natriumioner. Dette signalerer hypothalamus osmoreceptorer og sekretion fra de forreste hypofyse-nerveender af ADH, hvilket stimulerer vandreabsorption fra opsamlingskanalerne. Angiotensin II, der har en stærk vasokonstriktiv effekt, øger blodtrykket og øger også tørsten. Vandet, der følger med at drikke, bliver i højere grad end normalt tilbageholdt i kroppen.
 Ris. 11.19. Renin-angiotensin-aldosteron-systemet.
Ris. 11.19. Renin-angiotensin-aldosteron-systemet.
ACE - angiotensin-konverterende enzym (et andet navn for carboxypeptidyldipeptidase)
Nedsat væskevolumen og nedsat blodtryk aktiverer renin-angiotensin-aldosteron-systemet;
Angiotensin II forårsager forbigående vasokonstriktion og en stigning i blodtrykket;
Aldosteron stimulerer natriumretention, hvilket resulterer i frigivelse af vasopressin og øget vandreabsorption;
Angiotensin II forårsager også en følelse af tørst, hvilket bidrager til en stigning i væske i kroppen.
En stigning i væskevolumen og en stigning i blodtrykket fører til eliminering af den stimulus, der forårsagede aktiveringen af renin-angiotensin-systemet og udskillelsen af aldosteron, og som følge heraf fører til genoprettelse af blodvolumen.
7. Et fald i perfusionstrykket i de renale glomeruli kan også forekomme på grund af forsnævring (stenose) af nyrearterien eller nefrosklerose. I dette tilfælde er hele renin-angiotensin-systemet også tændt. Men da startvolumenet og blodtrykket er normalt, fører inddragelsen af systemet til en stigning i blodtrykket over normen og udviklingen af den såkaldte renal hypertension.
8. Hyperaldosteronisme - er en sygdom forårsaget af hypersekretion af aldosteron i binyrerne. årsag primær hyperaldosteronisme (Kohns syndrom) er et adenom i binyrerne eller diffus hypertrofi af cellerne i den glomerulære zone, der producerer aldosteron. Ved primær hyperaldosteronisme øger overskydende aldosteron natriumreabsorption i nyretubuli. En stigning i koncentrationen af Na+ i plasma tjener som en stimulans til nyrernes sekretion af antidiuretisk hormon og vandretention. Derudover forstærkes udskillelsen af kalium, magnesium og protonioner. Som et resultat udvikles hypernatriæmi, hvilket især forårsager hypertension, hypervolæmi og ødem; hypokaliæmi, der fører til muskelsvaghed, samt magnesiummangel og metabolisk alkalose. årsag sekundær hyperaldosteronisme er et øget niveau af renin og angiotensin II, stimulerer det binyrebarken og fører til overdreven syntese af aldosteron. Kliniske symptomer er mindre udtalte end ved primær aldosteronisme. Samtidig bestemmelse af aldosteronkoncentration og plasmareninaktivitet gør det muligt endeligt at differentiere primær (plasma-reninaktivitet er reduceret) og sekundær (plasma-reninaktivitet øges) hyperaldosteronisme.
9. Atriel natriuretisk faktor (ANF)- et peptid, der syntetiseres og lagres som et prohormon i kardiocytter. Den vigtigste faktor, der regulerer sekretionen af PNP, er en stigning i blodtrykket. De vigtigste målceller for PNP er nyrerne, binyrerne og perifere arterier. Plasmamembran-PNP-receptoren er en katalytisk receptor med guanylatcyclaseaktivitet. Som resultat
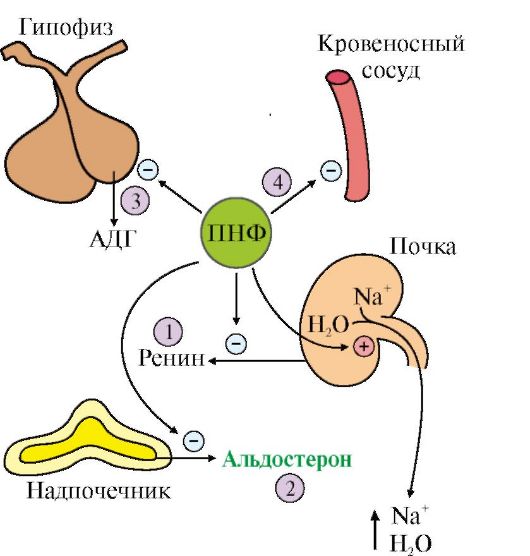 Ris. 11.20. Effekter af PNF-handling:
Ris. 11.20. Effekter af PNF-handling:
1 - hæmmer frigivelsen af renin; 2 - hæmmer udskillelsen af aldosteron; 3 - hæmmer udskillelsen af ADH; 4 - forårsager afslapning af blodkar
binding af PNP til receptoren, øges receptorens guanylatcyclaseaktivitet, og cyklisk GMP dannes ud fra GTP. Som et resultat af virkningen af PNP hæmmes dannelsen og sekretionen af renin og aldosteron. Nettoeffekten af PNP er at øge udskillelsen af Na + og vand og sænke blodtrykket (fig. 11.20).
PNP betragtes generelt som en fysiologisk angiotensin II-antagonist, da den forårsager vasodilatation og tab af salt og vand.
TEMA 11.9. REGULERING AF CALCIUM- OG FOSFAT-METABOLISME. STRUKTUR, SYNTESE OG VIRKNINGSMEKANISME AF PARATHORMONE, CALCITRIOL OG CALCITONIN
1. En voksens krop indeholder -1,2 kg calcium. Den vigtigste fond af calcium i kroppen er knoglecalcium (99% af alt calcium i kroppen). En anden fond er calciumioner opløst i væsker eller kombineret med proteiner i væsker og væv. Koncentrationen af calcium inde i celler afhænger af dets koncentration i den ekstracellulære væske. Koncentrationen af Ca 2 + i blodet hos raske mennesker er 2,12-2,6 mmol / l (9-11 mg / dl), i den intracellulære væske - tusind gange mindre.
Calcium er den vigtigste mineralske strukturelle komponent i knoglevæv. Calciumioner er involveret i muskelsammentrækning, øger cellemembranens permeabilitet for kaliumioner, påvirker cellernes natriumledningsevne, driften af ionpumper, fremmer udskillelsen af hormoner, deltager i kaskademekanismen for blodkoagulation og tjener som de vigtigste mediatorer i intracellulær signaltransmission.
Koncentrationen af Ca 2 + i plasma reguleres med høj præcision: dens ændring med kun 1 % aktiverer homeostatiske mekanismer, der genopretter balancen. De vigtigste regulatorer af Ca 2+ metabolisme i blodet er parathyreoideahormon, calcitriol og calcitonin.
2. Parathormon Det syntetiseres af biskjoldbruskkirtlerne som et præprohormon, som derefter omdannes til det modne hormon ved delvis proteolyse. PTH udskilles som reaktion på et fald i calciumniveauet i blodet. De vigtigste målorganer for hormonet er knogler og nyrer (fig. 11.21).
Hormonet initierer en kaskade af begivenheder forbundet med osteoblastadenylatcyklase, der stimulerer osteoklasternes metaboliske aktivitet. Der sker en mobilisering af Ca 2+ fra knoglen og indtrængen af fosfater i blodet, og i nyrernes distale tubuli stimuleres Ca 2+ reabsorption og fosfatreabsorption falder, hvilket resulterer i genoprettelse af det normale niveau af calcium ioner i den ekstracellulære væske.
3. Calcitriol ligesom andre steroidhormoner syntetiseres det ud fra kolesterol. Den umiddelbare forløber for calciferol er cholecalciferol (vitamin D3). En lille mængde D3-vitamin er indeholdt
 Ris. 11.21 Effekter af PTH-handling:
Ris. 11.21 Effekter af PTH-handling:
1 - PTH stimulerer mobiliseringen af calcium fra knoglen; 2 - PTH stimulerer reabsorptionen af calciumioner i nyrernes distale tubuli; 3 - PTH aktiverer dannelsen af 1,25(OH) 2 D 3 i nyrerne, hvilket fører til stimulering af Ca 2 + absorption i tarmen
i fødevarer, men det meste af vitaminet, der bruges i syntesen af calcitriol, dannes i huden fra 7-dehydrocholesterol under en ikke-enzymatisk reaktion under påvirkning af ultraviolet lys. Dannelsen af calcitriol fra vitamin D 3 begynder i leveren og ender i nyrerne (fig. 11.22).
I leveren hydroxyleres cholecalciferol ved det 25. carbonatom til dannelse af 25-hydroxycholecalciferol. Hydroxylering, der forekommer i nyrerne under påvirkning af enzymet 1o-hydroxylase, er et hastighedsbegrænsende trin og fører til dannelsen af calcitriol 1,25(OH) 2 D 3 - den aktive form af vitamin D 3 . Enzymet i denne reaktion aktiveres af en lav koncentration af Ca 2 + ioner i blodet og parathyreoideahormon. En stigning i koncentrationen af calcitriol hæmmer tværtimod syntesen af 1o-hydroxylase i nyrerne, hvilket hæmmer dannelsen af hormonet. Ved at blive transporteret gennem blodet i et kompleks med et bærerprotein, binder calcitriol til en intracellulær receptor, interagerer med kromatin og ændrer translationshastigheden. Som et resultat syntetiseres proteiner i målceller, der sikrer absorption af calcium og fosfater til enterocytter.
4. Calcitonin - et polypeptid bestående af 32 aminosyrerester med en disulfidbinding. Hormonet udskilles af parafollikularen
 Ris. 11.22 Skema til syntese af calcitriol:
Ris. 11.22 Skema til syntese af calcitriol:
1 - kolesterol er en forløber for calcitriol; 2 - i huden omdannes 7-dehydrocholesterol ikke-enzymatisk til cholecalciferol under påvirkning af UV-bestråling; 3 - i leveren omdanner 25-hydroxylase cholecalciferol til calcidiol; 4 - i nyrerne katalyseres dannelsen af calcitriol af 1o-hydroxylase
K-celler i skjoldbruskkirtlen eller C-celler i biskjoldbruskkirtlen i form af et forstadieprotein med høj molekylvægt. Sekretionen af calcitonin stiger med en stigning i koncentrationen af Ca 2 + og falder med et fald i koncentrationen af Ca 2 + i blodet. Calcitonin hæmmer frigivelsen af Ca 2 + fra knogler og stimulerer dets udskillelse af nyrerne i urinen.
5. hypocalcæmi og hypercalcæmi, når koncentrationen af calcium i blodplasmaet er lavere eller højere end normalt, indikerer en patologi. En ændring i niveauet af calcium i blodet påvirker koncentrationen af calcium inde i cellerne, hvilket fører til en ændring i excitabilitetstærsklen for nerve- og muskelceller, en forstyrrelse af calciumpumpens funktion, et fald i enzymaktivitet og en krænkelse af den hormonelle regulering af stofskiftet. Med hypocalcæmi observeres hyperreflekser, kramper, spasmer i strubehovedet. Med hypercalcæmi observeres et fald i neuromuskulær excitabilitet, en dyb forstyrrelse af nervefunktioner, psykose, stupor og koma kan forekomme.
6. Hyperparathyroidisme. Overdreven sekretion af parathyreoideahormon, som følge af en tumor i biskjoldbruskkirtlen, diffus hyperplasi af kirtlerne, parathyreoideacarcinom (primær hyperparathyroidisme), fører til øget mobilisering af calcium og fosfat fra knoglen, øget calciumreabsorption og udskillelse af fosfat i nyrerne . Som følge heraf opstår hypercalcæmi, hvilket kan føre til et fald i neuromuskulær excitabilitet og muskelhypotension. Patienter udvikler generel svaghed og muskelsvaghed, træthed og smerter i visse muskelgrupper, og risikoen for brud på rygsøjlen, lårbenet og knoglerne i underarmen øges. En stigning i koncentrationen af fosfat- og calciumioner i nyretubuli kan forårsage dannelse af nyresten og føre til hyperfosfaturi og hypofosfatæmi.
7. Hypoparathyroidisme. Det vigtigste symptom på hypoparathyroidisme på grund af parathyreoideainsufficiens er hypocalcæmi. Et fald i koncentrationen af calciumioner i blodet kan forårsage neurologiske, oftalmiske og kardiovaskulære lidelser samt bindevævsskade. En patient med hypoparathyroidisme har en stigning i neuromuskulær ledning, anfald af toniske kramper, kramper i åndedrætsmusklerne og mellemgulvet og laryngospasme.
8. Rakitis- en børnesygdom forbundet med utilstrækkelig mineralisering af knoglevæv. Krænkelse af knoglemineralisering er en konsekvens af calciummangel og kan skyldes følgende årsager: mangel på vitamin D 3 i kosten, nedsat optagelse af vitamin D 3 i tyndtarmen, nedsat syntese af calcitriol-prækursorer på grund af utilstrækkelig tid i sun, en defekt i Ια-hydroxylase, en defekt calcitriolreceptorer i målceller. Alt dette forårsager et fald i calciumabsorptionen i tarmen og et fald i dets koncentration i blodet, stimulering af sekretionen af parathyreoideahormon og som følge heraf,
Dette er mobiliseringen af calciumioner fra knoglen. Ved rakitis påvirkes kraniets knogler, brystet sammen med brystbenet rager frem, de rørformede knogler og led i arme og ben deformeres, og maven forstørres og rager frem. Den vigtigste måde at forhindre rakitis på er korrekt ernæring og tilstrækkelig stråling.
OPGAVER TIL EKSTRA KURSARBEJDE
Løse problemer
1. Undersøg mekanismerne for regulering af opretholdelse af vandbalancen, husk de stimuli, der forårsager udskillelsen af hormoner og funktionerne i mekanismen for deres virkning (fig. 11.19). Tegn et diagram over hændelsesforløbet i genoprettelsen af vand-saltbalancen efter at have spist salt mad.
2. Hos en 23-årig mand, under en kirurgisk operation for at fjerne en tumor fra den øvre del af den forreste hypofyse, blev landtangen i den bageste hypofyse påvirket. I den postoperative periode udviklede patienten polyuri. Hvordan kan du forklare udseendet af dette symptom hos denne patient? For at underbygge dit svar:
a) navngiv de hormoner, der syntetiseres i hypothalamus og udskilles fra den bageste hypofyse;
b) tegn et diagram over signaltransmission af dette hormon til målceller;
c) Nævn virkningerne af dette hormon.
3. Husk skemaet for syntesen af steroidhormoner (fig. 11.8) og skriv sekvensen af trin i syntesen af aldosteron ned i en notesbog.
4. Tegn dit eget diagram, der illustrerer virkningerne af aldosteron og dets virkningsmekanisme.
5. Undersøg skemaet for regulering af syntesen og sekretionen af aldosteron med deltagelse af renin-angiotensin-systemet (fig. 11.19) og vælg de manglende komponenter angivet i diagrammet (fig. 11.23) med tal.
6. Lav dit eget diagram, der forklarer hovedresultaterne af virkningen af PNF (fig. 11.20), og besvar spørgsmålet, hvad er grundlaget for den hypotensive effekt
7. Udfyld tabellen. 11.3.
Tabel 11.3. Karakteristika af hormoner, der regulerer vand-salt metabolisme
 Ris. 11.23. Ordning for regulering af vand-salt-homeostase
Ris. 11.23. Ordning for regulering af vand-salt-homeostase
8. Udfyld tabellen. 11.4.
Tabel 11.4. Karakteristika for hormoner, der regulerer calcium- og fosfatmetabolismen
9. Ved at bruge diagrammet i fig. 11.22, angive alle mulige årsager til rakitis og præsentere et diagram over mekanismen for signaltransmission af calcitriol til målceller.
10. Med hypovitaminose D 3 forstyrres processen med knoglemineralisering, indholdet af calcium og fosfater i dem falder; koncentrationen af Ca 2 + i blodet forbliver inden for normalområdet eller falder lidt. Lav et skema for opretholdelse af Ca 2 + homeostase ved hypovitaminose D 3 og bestem:
a) på grund af hvilke kilder opretholdes den normale koncentration af Ca 2 + i blodet i dette tilfælde;
b) hvordan koncentrationen af calcitonin og parathyreoideahormon i blodet vil ændre sig.
11. Øget udskillelse af calcium i urinen kan være årsag til dannelsen af nyresten, der hovedsageligt består af calciumoxalat. Nævn årsagerne til, at Ca2-udskillelsen kan stige.
OPGAVER TIL SELVKONTROL
1. Vælg det rigtige svar.
Som reaktion på en stigning i osmotisk tryk øges syntesen og sekretionen af hormonet:
A. Aldosteron B. Cortisol
B. Vasopressin D. Adrenalin D. Glucagon
2. Sæt en kamp.
Sted for syntese:
A. Lever B. Nyrer
B. Hypothalamus D. Binyrer
D. Pancreas
Metabolitter:
1. Vasopressin
2. Aldosteron
3. Sæt match:
A. Stimulansen til syntese og sekretion er dannelsen af angiotensin II B. Stimulansen til sekretion er en stigning i koncentrationen af natriumioner
B. Målorganer - perifere arterier
D. Hyperproduktion af hormonet fører til polyuri D. Syntesested - lever
1. Vasopressin
2. Aldosteron
3. Angiotensinogen
4. Vælg det rigtige svar. Angiotensin II:
A. Dannet i leveren
B. Er et proteolytisk enzym
B. Er et substrat for renin
D. Stimulerer syntesen af aldosteron D. Stimulerer vasokonstriktion
5. Vælg det rigtige svar.
Calcitriol:
A. Stimulerer calcium reabsorption i nyrerne
B. Er en forløber for 7-dehydrocholesterol
B. Stimulerer natriumreabsorption i nyrerne
D. Øger hastigheden af calciumabsorption i tarmen D. Stimulerer mobiliseringen af calcium fra knogler
6. Vælg det rigtige svar.
Et fald i koncentrationen af Ca 2 + i blodplasma forårsager:
A. Øget sekretion af parathyreoideahormon
B. Hæmning af aktiviteten af parafollikulære celler i skjoldbruskkirtlen
B. Hydroxylering af vitamin D-metabolitter 3 D. Reduktion af calciumudskillelse i nyrerne
D. Øge hastigheden af knogleresorption
7. Fuldfør "kæde"-opgaven:
en) Hormonet produceret i hypothalamus er:
A. Vasopressin B. Adrenalin
B. Aldosteron G. Calcitriol
b) målceller for dette hormon er:
A. JUGA-celler
B. Perifere arterier
B. Celler i samlekanalerne og distale tubuli D. Celler i nefron glomerulus
i) binding til disse cellers receptorer stimulerer det:
A. Adenylatcyclasesystem B. Phosphoproteinphosphatase
B. Inositol triphosphat system D. Renin-angiotensin system.
G) som et resultat af aktiveringen af dette system øges mængden af protein:
A. Albumin
B. Natriumtransportører
B. Aquaporina-2
G. Kaliumtransportør
e) dette protein giver en stigning i reabsorption:
A. Kaliumioner B. Calciumioner
B. Natriumioner D. Vand
8. Vælg det rigtige svar. Parathormon:
A. Det transporteres gennem blodet i et kompleks med et bærerprotein B. Sekretion reguleres af koncentrationen af calcium i blodet
B. Hormonmangel fører til et fald i koncentrationen
D. Til manifestation af biologisk aktivitet kræves hele hormonets molekyle D. Øger effektiviteten af vandabsorption i tarmen
9. Vælg det rigtige svar.
Vasopressin:
A. Stimulerer en stigning i det osmotiske tryk af blodplasma B. Aktiverer proteinkinase C i nyrerne
B. Stimulerer vandreabsorption i nyrerne
D. Reducerer det osmotiske tryk af blodplasma D. Stimulerer ekspressionen af aquaporin-2-genet
10. Sæt match:
A. Viser en vasokonstriktiv effekt B. Stimulerer Na+ reabsorption
B. Interagerer med membranreceptorer i målceller D. Forøger reninsekretion
D. Er et proteolytisk enzym
1. Aldosteron
2. Angiotensin II
11. Vælg alle rigtige svar. PNF:
A. Interagerer med membranreceptorer i målceller B. Aktiverer phospholipase C
B. Aktiverer guanylatcyclase
D. Undertrykker sekretionen af aldosteron D. Øger udskillelsen af vand og Na +
12. Sæt match:
A. I nyrerne B. I huden
B. I leveren D. I hjernen
D. I tarmene
1. Omdannelse af 7-dehydrocholesterol til vitamin D 3 ved ikke-enzymatisk fotolyse
2. Dannelse af 1,25 (OH)2D 3 i en monooxygenase reaktion, der involverer NADPH
3. Induktion af calciumbindende proteinsyntese STANDARDER FOR SVAR PÅ "OPGAVER TIL SELVKONTROL"
1. PÅ 7. a) A, b) C, c) A, d) C, e) D
2. 1-B; 2-D; 3-B 8. B, C
3. 1-B; 2-A; 3-D 9. C, D, D
4. G, D 10. 1-B; 2-A; 3-D
5. A, G, D 11. A, C, D, D
6. A, C, D, D 12 .1 - B; 2 - B; 3 - D
GRUNDLÆGGENDE VILKÅR OG KONCEPT
1. Vand-salt homeostase
2. Diabetes insipidus
3. Renin-angiotensin-aldosteron system
4. Hyperaldosteronisme
5. Hypercalcæmi
6. Hypokalcæmi
7. Hypoparathyroidisme
8. Hyperparathyroidisme
OPGAVER TIL AUDITIONELLT ARBEJDE
Løse problemer
1. Nogle former for hypertension skyldes forskellige nyresygdomme, såsom kompression af nyrearterien af en tumor. Den vigtigste behandlingsmetode i sådanne tilfælde er fjernelse af det berørte organ (nyre). Imidlertid bemærkes en forbedring af patienternes tilstand, når patienterne får ordineret lægemidler, der er ACE-hæmmere. Tegn et diagram, der viser ændringen i vand-saltmetabolisme under nyrearteriekompression. Som følge af hvilke ændringer forbedres patientens tilstand?
2. En patient kom til lægen med klager over hyppig vandladning og en konstant følelse af tørst. Undersøgelsen bemærkede en stigning i den daglige mængde urin med et kraftigt fald i dens tæthed. Analysen viste, at insulinniveauet var inden for normalområdet, men der blev afsløret en stigning i indholdet af det hormon, der er ansvarlig for vandgenoptagelsen. Hvad er årsagen til polyuri hos denne patient? For at besvare et spørgsmål:
a) navngiv dette hormon;
b) liste de stimuli, der forårsager dets sekretion;
c) navngiv typerne af receptorer for dette hormon og deres placering;
d) giv skemaet for signaltransmission af dette hormon i nyrerne;
e) beskrive virkningerne af hormonet i målvæv;
f) Giv et diagram over reguleringen af sekretionen af dette hormon.
3. En 48-årig mand konsulterede en læge med klager over svaghed, muskelsmerter, forstoppelse og nylige anfald af smerter i ryggen og under vandladning. Ved undersøgelsen blev patienten diagnosticeret med primær hyperparathyroidisme som følge af udviklingen af en hypersekretorisk benign tumor i venstre lap af biskjoldbruskkirtlen.
Forklar hvorfor nefrolithiasis kan udvikle sig ved hyperparathyroidisme? Når du løser problemet, skal du bruge diagrammerne til opgave 5.
4. En kvinde henvendte sig til børnelægen med klager over, at hendes to-årige søn var blevet lunefuld, irritabel og ikke spiste godt. Sveden dukkede op, afføringen var ustabil. Ved undersøgelse blev der konstateret compliance af kraniets knogler, deformitet af brystet. I en biokemisk blodprøve er niveauet af total calcium 1,57 mmol / l (normen er 2,3-2,8 mmol / l). Gæt hvilken sygdom dette barn lider af. For det:
a) sammenligne mængden af total calcium i blodet hos et barn med normen, giv et navn til denne tilstand;
b) angive de mulige årsager, der kan føre til udviklingen af denne sygdom;
c) give skemaet for syntese af hormonel regulering af calciummetabolisme;
d) angive virkningsmekanismen for hormoner, årsagerne og konsekvenserne af deres insufficiens i kroppen;
5. Studer diagrammet:
Årsager og konsekvenser af hypoparathyroidisme (Fig. 11.24). Lav lignende diagrammer for:
a) hyperparathyroidisme;
b) rakitis
 Ris. 11.24. Årsager og konsekvenser af hypoparathyroidisme
Ris. 11.24. Årsager og konsekvenser af hypoparathyroidisme
|
introduktion Separat mad I.1 Separate måltider har en historie I.2 En fuldstændig afvisning af noget er udelukket I.4 Adskilte måltider, fordi det giver mening I.6 Balance er nøglen I.9 Vores essentielle planteprodukter I.14 Problemer for dem, der spiser ude I.14 Døgnrytmer for fordøjelsen mad og sygdom II.1 Ernæring, kropsvægt og hormonstatus II.3 Migræne og ernæring II.4 Fødevarer og infektionssygdomme II.5 Fedtstoffer, stress og ernæring II.6 Sød mad - bitter gengældelse Konklusion Bibliografi Ansøgninger Bilag 1. En voksens gennemsnitlige daglige balancerede behov for næringsstoffer og energi (balanceret ernæringsformel af A. A. Pokrovsky) |
INTRODUKTION
Rusland har en lav videnskultur med hensyn til ernæring. De er baseret på traditionelle tilgange uden at tage højde for ændringerne i sammensætningen af forbrugte produkter, de er ikke enige og modsiger ofte viden om menneskelig fysiologi.
Så hvad sker der med vores traditionelle kost? Grød med smør (stivelse med fedtstoffer) eller grød med mælk (stivelse med proteiner), der kommer ind i maven, bliver til en blanding af sure og basiske miljøer, som neutraliserer hinanden. I et neutralt miljø nedbrydes næringsstoffer ikke, men bearbejdes af forrådnelsesbakterier, der lever i maven. Som et resultat dannes der en rådnende "skraldeplads". For at slippe af med det, er kroppen tvunget til at mobilisere sit forsvar, producere et stort antal leukocytter, som forbruger yderligere energi, så hvis du efter en traditionel morgenmad snart vil spise, så forblev kroppen (dens celler) sulten , og brugte sin styrke på at neutralisere "skraldet" (fødevareleukocytose).
Traditionel frokost - suppe på kødbouillon - fedtstoffer + stivelse + proteiner. Igen vil situationen med overfyldning af maven, som er forvekslet med mæthed, vise sig.
Den menneskelige krop har en meget stor sikkerhedsmargin. Videnskabelige beregninger viser, at levetiden kan være 400 år. Unge spiser alt og siger, at alt er i orden. Men allerede efter 30-35 år begynder en person at erhverve sig en "buket af sygdomme". Om morgenen er der ingen munterhed, om eftermiddagen - døsighed, om aftenen - træthed - dette bliver den normale tilstand for en moden person. Det burde ikke være sådan. Fødslen af syge børn (raske børn fødes næsten aldrig) indikerer, at menneskehedens sikkerhedsmargin er udtømt. Naturlig udvælgelse er begyndt. Mængden af sundhed falder med hver generation. Hvis vi tager vores bedstefædres helbred som 100%, så har fædrene 50%, vores generation - børn - 25%, den næste generation er helt syg fra undfangelsesøjeblikket. Overlevelse sikres kun ved medicin, forebyggende foranstaltninger, korrekt ernæring og overholdelse af en sund livsstil.
Separat mad
Tak
Siden giver kun referenceoplysninger til informationsformål. Diagnose og behandling af sygdomme bør udføres under tilsyn af en specialist. Alle lægemidler har kontraindikationer. Ekspertrådgivning er påkrævet!
Hvad er en hormonel ubalance?
De endokrine kirtler i den menneskelige krop producerer omkring 70 hormoner. Det normale forhold mellem disse hormoner og hinanden sikrer stabiliteten af de vitale processer i en sund organisme. Men det er værd at øge eller mindske produktionen af mindst ét hormon, som hormonel lidelse(fiasko). Især ofte er der en hormonel svigt hos kvinder i strid med syntesen af kvindelige kønshormoner.Tegn på hormonel svigt i den kvindelige krop kan være anderledes: først og fremmest er dette en krænkelse af menstruationscyklussen. Derudover kan hormonelle kvindelige lidelser manifestere sig:
- overdreven eller utilstrækkelig hårvækst;
- underudvikling af mælkekirtlerne;
- pludselig vægtøgning;
- nervøsitet, irritabilitet eller depression;
- overdreven svedtendens;
- hovedpine og mange andre symptomer.
Årsager til hormonel ubalance hos kvinder
Den skrøbelige kvindelige hormonbalance kan forstyrres af en række faktorer:- dårlige vaner (rygning, alkoholmisbrug);
- irrationel ernæring;
- kronisk søvnmangel;
- stillesiddende livsstil eller omvendt overdreven fysisk aktivitet;
- hyppig brug af hormonelle præventionsmidler;
- hyppige aborter;
- overførte infektioner (ARVI, tonsillitis, gonoré, klamydia, syfilis osv.).
Metoder til behandling af hormonelle lidelser
Selvfølgelig behandles først og fremmest hormonelle forstyrrelser med hormonelle lægemidler. Men i de fleste tilfælde kan den hormonelle baggrund genoprettes ved hjælp af ikke-medicinske behandlingsmetoder, som omfatter:- en sund livsstil (tilstrækkelig søvn, bevægelse i den friske luft, morgenøvelser, afvisning af dårlige vaner);
- korrekt ernæring (diæt med en overvægt af vegetabilske produkter og vegetabilske fedtstoffer);
- fysioterapiøvelser;
- fysioterapi, herunder massage;
- balneoterapi (bade med forskellige mineralvand);
- Spa behandling.
Ernæring til hormonelt svigt
 I tilfælde af krænkelse af den hormonelle status skal kvinder ændre deres daglige kost ved at inkludere så meget planteføde som muligt - grøntsager, frugter, bær, svampe. Faktum er, at disse produkter indeholder fytoøstrogener - stoffer, der har egenskaber, der ligner dem for kvindelige kønshormoner.
I tilfælde af krænkelse af den hormonelle status skal kvinder ændre deres daglige kost ved at inkludere så meget planteføde som muligt - grøntsager, frugter, bær, svampe. Faktum er, at disse produkter indeholder fytoøstrogener - stoffer, der har egenskaber, der ligner dem for kvindelige kønshormoner. Fytoøstrogener findes i bælgfrugter (ærter, bønner), hvedekorn og -kim og løg. De findes også i æg (kylling, vagtler osv.). For eksempel er en omelet med løg og svampe en typisk "feminin" ret, der indeholder en betydelig mængde fytoøstrogener.
Ved hormonelle kvindelige lidelser er der behov for produkter indeholdende zink og selen for at normalisere produktionen af kroppens egne hormoner. Sådanne fødevarer omfatter magert kød (oksekød), svinefedt, havregryn, mælk, alle bladgrøntsager (salat, kål, dild, persille, spinat, basilikum, brøndkarse osv.), nødder (jordnødder, mandler, pistacienødder), græskarkerner, hvidløg .
Det anbefales at udelukke fra kosten (eller begrænse til et minimum) sådanne fødevarer som sukker, honning, kager, slik, chokolade, kondenseret mælk, kartofler, kød (svinekød, gås, and), dåsemad, pølser, pølser.
Hvis hormonsvigt har ført til en kraftig stigning i vægten, opnås vægttab ved hjælp af en hormonel (metabolisk) diæt.
Hormonal kost
Denne diæt aktiverer syntesen af hormoner, der fremmer fedtforbrændingen (testosteron, adrenalin, noradrenalin) og hæmmer produktionen af hormoner, der forårsager ophobning af fedt i kroppen (insulin, østrogen).Faser af den hormonale diæt:
1.
Hurtig og aktiv fedtforbrænding (ca. 2 uger).
2.
Stabil fedtforbrænding (ubestemt varighed).
3.
Fastholdelse af vægten på det opnåede lave niveau.
For at lette udarbejdelsen af den daglige menu i forskellige faser af den hormonale diæt, er alle fødevarer opdelt i 5 grupper med forskellig score. Jo højere score, jo stærkere aflejring af fedt ved brug af dette produkt. Og omvendt: produkter, der er tildelt "0 point"-gruppen, bidrager ikke til aflejring af fedt, men til deres forbrænding.
| Points | Mad |
| 0 | Æg, fisk, rejer, blæksprutte, muslinger, kanin, kylling (hvidt kød fra brystet), kalkun (hvidt kød fra brystet), svampe, grøntsager, lime, citron, dild, persille, sennep, peberrod, grønne ærter, mejeriprodukter produkter med et fedtindhold på højst 2 %. |
| 1 | Bær, bønner, friskpresset juice fra grøntsager. |
| 2 | Kylling, oksekød, kalvekød, vegetabilske olier, nødder (valnødder, hasselnødder, pistacienødder), brød med klid, kogte gulerødder og rødbeder, frugter, oliven, oliven, fetaost, fetaost, brune ris, havregryn, boghvede, fedtfri mejeri produkter mere end 4%. |
| 3 | Eventuelle oste, hirse, yoghurt med tilsætningsstoffer, mørk chokolade, mysli, friskpresset frugtjuice. |
| 4 | Svinekød, and, gås, pølser, pølser, kartofler, sukker, honning, tørret frugt, muffins, mælkechokolade, slik, is, semulje, dåsemad i olie, mejeriprodukter med et fedtindhold på mere end 4 %. |
Ved at overholde en hormonal diæt skal du følge følgende regler i hver af dens faser:
1.
På én gang kan du ikke spise mere end 250-300 ml mad (volumen er lidt mere end 1 glas), uanset om det er frokost, morgenmad eller aftensmad.
2.
Mellem måltiderne bør der ikke gå mere end tre timer.
3.
Sørg for at drikke 2 (eller mere) liter vand om dagen.
Madplanen er nogenlunde som følger:
- Morgenmad - senest kl. 10.00;
- 2. morgenmad - senest kl. 12.00;
- Frokost - senest kl. 15.00;
- Eftermiddagssnack - senest kl. 18.00;
- Aftensmad - senest kl. 20.00.
Ernæring i 1. fase af den hormonale diæt må være meget sparsom. Kun fødevarer, der indeholder 0 point, kan indtages. Olivenolie er tilladt i mængden af 1 spsk pr. dag.
Samtidig er vægten hurtigt faldende, så du skal nøje overvåge dit velbefindende. Med en pludselig begyndende svaghed, mørkere øjne, tinnitus - skal du straks drikke stærk sød te og lægge dig ned. Sådanne symptomer er et signal om, at du skal gå videre til 2. fase af den hormonale diæt. Under alle omstændigheder er varigheden af 1. fase ikke mere end to uger.
Ernæring i 2. fase af den hormonelle diæt forekommer som følger:
- Morgenmad - 4 point;
- 2. morgenmad - 2 point;
- Frokost - 2 point;
- Eftermiddagssnack - 1 point;
- Aftensmad - 0 point.
Vælg for eksempel 1 produkt fra en 3-punktsliste + 1 produkt fra en 1-punktsliste + et vilkårligt antal 0-punktsprodukter (glem ikke den begrænsede samlede mængde!).
Eller: 1 produkt for 4 point + flere 0-point produkter.
Eller: 2 produkter fra listen med 2 point.
På samme måde skal du vælge mad til hvert måltid. Det samlede antal point kan være mindre end det anbefalede, men i intet tilfælde mere. Hvis et måltid springes over, tilføjes dets point ikke til det næste måltid.
2. fase af den hormonale diæt har ingen varighedsbegrænsninger. Vægten reduceres gradvist og jævnt. Når du opnår det ønskede resultat, gå videre til 3. fase.
Ernæring i 3. fase af den hormonale diæt udføres som følger: vælg et måltid (for eksempel frokost), og tilføj 1 point til det. Styr din vægt. Hvis vægttabet fortsætter, kan du tilføje 1 point til et andet måltid. Tilføjelsen af point fortsætter, indtil vægttabet stopper.
hCG hormonal diæt
 Der er en anden diæt til vægttab, som også kaldes hormonel, men resultaterne af dens brug er meget tvivlsomme. Denne diæt består i, at der kun bruges fødevarer med lavt kalorieindhold i kosten, og kvinden får samtidig injektioner af hCG-hormonet (humant choriongonadotropin). Normalt syntetiseres dette hormon i den kvindelige krop under graviditeten.
Der er en anden diæt til vægttab, som også kaldes hormonel, men resultaterne af dens brug er meget tvivlsomme. Denne diæt består i, at der kun bruges fødevarer med lavt kalorieindhold i kosten, og kvinden får samtidig injektioner af hCG-hormonet (humant choriongonadotropin). Normalt syntetiseres dette hormon i den kvindelige krop under graviditeten. Der er ingen overbevisende beviser for effektiviteten af denne diæt, og introduktionen af hCG-hormonet kan føre til uforudsigelige resultater. Der er stor sandsynlighed for at udvikle endnu mere alvorlige hormonforstyrrelser. Derfor er videnskabelig medicin kategorisk imod brugen af denne diæt.
Fytoterapi til hormonforstyrrelser
Lægeurter kan hjælpe med at rette op på hormonel ubalance. I folkemedicin bruges infusioner og tinkturer af følgende planter til dette formål:- feltnelliker;
- oregano ("kvindegræs");
- lungeurt;
- gås cinquefoil;
- maj brændenælde;
- lind blomster;
- hørfrø mv.
Infusioner tilberedes oftest i henhold til standardskemaet (en spiseskefuld urter i et glas kogende vand, insister, indtil det er afkølet). Infusion af feltnelliker brygget på denne måde for kvindelige hormonelle svigt anbefales at blive drukket i to uger 4 gange om dagen, 1/4 kop.
Når der opstår en hormonel ubalance, udvikles der ofte amenoré (fravær af menstruation). I dette tilfælde anbefaler traditionel medicin at bruge løg eller deres skaller:
- Et glas løgskal hældes i 0,5 liter kogende vand, koges i 20 minutter, køles af, filtreres og tages tre gange om dagen i en spiseskefuld (før måltider).
- Tag 5 hoveder mellemstore løg og 3-4 fed hvidløg. Renset, knust og hældt med tre glas mælk. Ved lav varme bringes blandingen af løg og hvidløg til den er blød. Derefter fjernes de fra varmen, får lov til at køle lidt af og blandes med tre teskefulde honning. Blandingen tages 3 gange om dagen for en spiseskefuld, indtil medicinen løber tør (du skal opbevare den i køleskabet).
Fysioterapi mod hormonel ubalance
 Fysioterapimetoder bruges ofte til behandling af kvindelige hormonforstyrrelser. Disse metoder uden lægemiddeleksponering giver dig mulighed for at justere den forstyrrede menstruationscyklus, kurere ovariedysfunktion, amenoré og andre patologiske processer i den kvindelige krop forbundet med hormonsvigt. Derudover øger fysioterapeutiske behandlingsmetoder immunitet og kroppens samlede modstand mod skadelige miljøfaktorer.
Fysioterapimetoder bruges ofte til behandling af kvindelige hormonforstyrrelser. Disse metoder uden lægemiddeleksponering giver dig mulighed for at justere den forstyrrede menstruationscyklus, kurere ovariedysfunktion, amenoré og andre patologiske processer i den kvindelige krop forbundet med hormonsvigt. Derudover øger fysioterapeutiske behandlingsmetoder immunitet og kroppens samlede modstand mod skadelige miljøfaktorer. Med kvindelige hormonelle dysfunktioner er følgende fysioterapimetoder mest effektive:
- elektrisk stimulering af livmoderhalsen;
- akupunktur;
- laserterapi (herunder ILBI);
- elektroforese af kravezonen med novocain;
- galvanisering af hjernen;
- massage (generel og gynækologisk);
- hirudoterapi (behandling med igler).
Behandling med igler - hirudoterapi - er effektiv til enhver hormonal patologi, herunder kvindelige hormonelle svigt. Iglernes spyt indeholder stoffer, der stimulerer produktionen af hormoner, som kroppen mangler. For at korrigere hormonbalancen placeres igler normalt på sacrococcygeal-regionen. Placeringen af igler i denne zone genopretter ikke kun forstyrret hormonbalance, men stimulerer også rensningen af kroppen fra toksiner.
Laserterapi til hormonelle kvindelige dysfunktioner bruges i form af eksponering for indre organer (gennem bugvæggen eller gennem skeden), og i form af ILBI - intravenøs laserblodbestråling.
En laserstråles påvirkning af de indre organer er fuldstændig smertefri, har ingen bivirkninger og giver en langvarig effekt af behandlingen.
ILBI er en universel behandlingsmetode, sikker og yderst effektiv. Intravenøs blodbestråling med en lavfrekvent laser påvirker blidt kroppen, stimulerer selvreguleringssystemet og giver korrektion af hormonelle forstyrrelser. ILBI kan bruges alene eller som en del af kompleks behandling.
Korrektion af den mentale tilstand ved hormonforstyrrelser
 I nogle tilfælde lider den mentale tilstand hos patienter med hormonelle svigt så meget, at den har brug for særlig korrektion. Især ofte observeres psykoemotionelle lidelser i
I nogle tilfælde lider den mentale tilstand hos patienter med hormonelle svigt så meget, at den har brug for særlig korrektion. Især ofte observeres psykoemotionelle lidelser i


