19.06.2019
Langtidsvirkende inhalerede B2-agonister. Lægemidler
Beta-agonister
Beta-agonister(syn. beta-agonister, beta-agonister, β-agonister, β-agonister). Biologiske eller syntetiske stoffer, der forårsager stimulering af β-adrenerge receptorer og har en betydelig effekt på kroppens grundlæggende funktioner. Afhængig af evnen til at binde til forskellige undertyper af β-receptorer, isoleres β1- og β2-agonister.
Fysiologisk rolle af β-adrenerge receptorer
Kardioselektive β1-blokkere omfatter talinolol (Cordanum), acebutolol (Sektral) og celiprolol.
Brugen af beta-agonister i medicin
Ikke-selektive β1-, β2-agonister isoprenalin og orciprenalin bruges kortvarigt til at forbedre atrioventrikulær ledning og øge rytmen ved bradykardi
β1-agonister: dopamin og dobutamin bruges til at stimulere kraften af hjertesammentrækninger ved akut hjertesvigt forårsaget af myokardieinfarkt, myokarditis eller andre årsager.
korttidsvirkende β2-agonister, såsom fenoterol, salbutamol og terbutalin anvendes i form af aerosoler med afmålt dosis til at lindre et astmaanfald ved bronkial astma, kronisk obstruktiv lungesygdom (KOL) og andre broncho-obstruktive syndromer. Intravenøs fenoterol og terbutalin bruges til at reducere arbejdsaktivitet og med truslen om abort.
langtidsvirkende β2-agonister salmeterol anvendes til profylakse, og formoterol til både forebyggelse og lindring af bronkospasme ved bronkial astma og KOL i form af afmålte aerosoler. De kombineres ofte i samme aerosol med inhalerede glukokortikosteroider til behandling af astma og KOL.
Bivirkninger af beta-agonister
Ved brug af inhalerede beta-agonister er takykardi og tremor mest almindelige. Nogle gange - hyperglykæmi, excitation af centralnervesystemet, sænkning af blodtrykket. Ved parenteral brug er alle disse fænomener mere udtalte.
Overdosis
Det er karakteriseret ved et fald i blodtrykket, arytmier, et fald i ejektionsfraktionen, forvirring osv.
Behandling - brug af betablokkere, antiarytmika mv.
Brugen af β2-agonister hos raske mennesker øger midlertidigt modstanden mod fysisk aktivitet, da de "holder" bronkierne i en udvidet tilstand og bidrager til den tidlige "åbning af en anden vind". Ofte blev dette brugt af professionelle atleter, især cykelryttere. Det skal bemærkes, at på kort sigt øger β2-agonister træningstolerancen. Men deres ukontrollerede brug, som enhver form for doping, kan forårsage uoprettelig skade på helbredet. Til β2-adrenomimetika udvikles afhængighed (for at "holde åbne" bronkierne, skal du konstant øge dosis). Forøgelse af dosis fører til arytmier og risiko for hjertestop.
Salbutamol, den mest almindeligt anvendte til disse formål, tilhører kategori C i henhold til FDA-klassificeringen. Især kan salbutamol forårsage takykardi, hyperglykæmi hos moderen og fosteret; hypotension, lungeødem, overbelastning i det systemiske kredsløb hos moderen. Brugen af dette lægemiddel under graviditet kan også forårsage kredsløbsforstyrrelser i nethinden og retinopati hos nyfødte. Gravide kvinder med intermitterende astma, som skal tage korttidsvirkende beta-agonister mere end 2 gange om ugen, kan få ordineret langvarig grundbehandling. Tilsvarende kan DMARD'er gives til gravide kvinder med vedvarende astma, når behovet for korttidsvirkende beta-agonister opstår 2 til 4 gange om ugen.
langtidsvirkende β2-agonister
I tilfælde af svær vedvarende astma anbefaler Astma and Pregnancy Working Group en kombination af langtidsvirkende beta-agonister og ICS som det foretrukne lægemiddel. Brugen af den samme terapi er mulig i tilfælde af moderat vedvarende astma. I dette tilfælde foretrækkes salmaterol frem for formoterol på grund af længere erfaring med dets anvendelse; dette lægemiddel er det mest undersøgte blandt analoger. FDA-sikkerhedskategorien for salmeterol og formoterol er C. Det er kontraindiceret (især i første trimester) til lindring af astmaanfald af adrenalin og lægemidler indeholdende alfa-agonister (ephedrin, pseudoephedrin), selvom de alle også tilhører kategori C. For eksempel er brug af pseudoephedrin under graviditet forbundet med en øget risiko for føtal gastroschisis.
Til citat: Sinopalnikov A.I., Klyachkina I.L. b2-agonister: rolle og plads i behandlingen af bronkial astma // BC. 2002. Nr. 5. S. 236
Statens Institut for Postgraduate Medical Education af Den Russiske Føderations Forsvarsministerium, Moskva
Introduktion Behandling af bronkial astma (BA) kan betinget opdeles i to hovedområder. Den første er symptomatisk terapi, som hurtigt og effektivt lindrer bronkospasme, det førende kliniske symptom på BA. Den anden er antiinflammatorisk terapi, som bidrager til ændringen af sygdommens vigtigste patogenetiske mekanisme, nemlig betændelse i luftvejsslimhinden (AP).
Den centrale plads blandt midlerne til symptomatisk kontrol af astma er naturligvis optaget af b2-agonister, som er karakteriseret ved udtalt bronkodilatatoraktivitet (og bronkobeskyttende virkning) og et minimum af uønskede bivirkninger, når de anvendes korrekt.
Kort historie b 2 -agonister Historien om brugen af b-agonister i det 20. århundrede er den konsekvente udvikling og introduktion i klinisk praksis af lægemidler med stadigt stigende b 2 -adrenerg selektivitet og stigende virkningsvarighed.
Første gang sympatomimetisk adrenalin (epinephrin) blev brugt til behandling af AD-patienter i 1900. I begyndelsen blev adrenalin meget brugt både i injicerbar form og i form af inhalationer. Lægernes utilfredshed med den korte virkningstid (1-1,5 time), en lang række negative bivirkninger af lægemidlet var dog et incitament til yderligere at søge efter mere "attraktive" lægemidler.
I 1940 dukkede op isoproterenol - syntetisk katekolamin. Det blev ødelagt i leveren lige så hurtigt som adrenalin (med deltagelse af enzymet catechol-o-methyltransferase - COMT), og var derfor karakteriseret ved en kort virkningsvarighed (1-1,5 time), og metabolitterne dannede som følge heraf. af biotransformationen af isoproterenol (methoxyprenalin) havde b-adrenerg blokerende virkning. Samtidig var isoproterenol fri for sådanne uønskede hændelser forbundet med adrenalin som hovedpine, urinretention, arteriel hypertension osv. Studiet af isoproterenols farmakologiske egenskaber førte til etableringen af adrenoreceptor-heterogenitet. I forhold til sidstnævnte viste adrenalin sig at være en universel direkte a-b-agonist, og isoproterenol - den første korttidsvirkende ikke-selektive b-agonist.
Den første selektive b 2 -agonist blev introduceret i 1970. salbutamol , karakteriseret ved minimal og klinisk ubetydelig aktivitet mod a- og b1-receptorer. Han opnåede med rette status som "guldstandarden" i en række b 2 -agonister. Salbutamol blev efterfulgt af introduktion i klinisk praksis af andre b 2 -agonister (terbutalin, fenoterol, etc.). Disse lægemidler viste sig at være lige så effektive som bronkodilatatorer som ikke-selektive b-agonister, eftersom den bronkodilaterende virkning af sympatomimetika kun realiseres gennem b 2 -adrenerge receptorer. Samtidig viser b2-agonister en signifikant mindre udtalt stimulerende effekt på hjertet (batmotropisk, dromotropisk, kronotropisk) sammenlignet med b1-b2-agonist isoproterenol.
Nogle forskelle i selektiviteten af b2-agonister har ikke alvorlig klinisk betydning. Den højere frekvens af kardiovaskulære bivirkninger med fenoterol (sammenlignet med salbutamol og terbutalin) kan forklares med den højere effektive dosis af lægemidlet og til dels hurtigere systemisk absorption. De nye lægemidler bibeholdt deres virkningshastighed (indtræden af virkning i de første 3-5 minutter efter inhalation), karakteristisk for alle tidligere b-agonister, med en mærkbar stigning i varigheden af deres virkning op til 4-6 timer (mindre udtalt ved svær astma). Dette forbedrede evnen til at kontrollere astmasymptomer i løbet af dagen, men "reddede ikke" fra natteanfald.
Muligheden for at tage individuelle b 2 -agonister oralt (salbutamol, terbutalin, formoterol, bambuterol) løste til en vis grad problemet med at kontrollere natlige astmaanfald. Behovet for at tage betydeligt højere doser (næsten 20 gange mere end ved inhalation) bidrog imidlertid til fremkomsten af bivirkninger forbundet med stimulering af a - og b 1 -adrenerge receptorer. Derudover blev en lavere terapeutisk effekt af disse lægemidler også afsløret.
Forekomsten af langvarige inhalerede b 2 -agonister - salmeterol og formoterol - ændrede betydeligt mulighederne for BA-terapi. Dukkede først op på markedet salmeterol - meget selektiv b 2 -agonist, som viser en virkningsvarighed på mindst 12 timer, men med en langsom indsættende virkning. Snart kom han med formoterol , som også er en meget selektiv b 2 -agonist med en 12-timers effekt, men med en udviklingshastighed af en bronkodilaterende effekt svarende til salbutamols. Allerede i de første år med brug af forlængede b 2 -agonister blev det bemærket, at de bidrager til reduktion af forværringer af BA, et fald i antallet af indlæggelser og også et fald i behovet for inhalerede kortikosteroider (IGCS).
Den mest effektive måde at administrere lægemidler ved AD, herunder b 2 -agonister, er anerkendt som inhalation. Vigtige fordele ved denne rute er muligheden for direkte levering af lægemidler til målorganet (hvilket i høj grad sikrer bronkodilatatorers virkningshastighed) og minimering af uønskede virkninger. Af de aktuelt kendte indgivelsesmidler er aerosolinhalatorer til afmålte doser (MAI'er) de mest almindeligt anvendte, mindre almindelige inhalatorer med afmålt dosis (DPI) og forstøvere. Orale b 2 -agonister i form af tabletter eller sirupper anvendes ekstremt sjældent, hovedsageligt som et ekstra middel mod hyppige natlige symptomer på astma eller et højt behov for inhalerede korttidsvirkende b 2 -agonister hos patienter, der får høje doser af ICS (ækvivalent til 1000 mcg beclomethason om dagen eller mere).
Virkningsmekanismer b 2 -agonister b 2 -agonister forårsager bronkodilatation primært som et resultat af direkte stimulering af b 2 -adrenerge receptorer af de glatte muskler i DP. Bevis for denne mekanisme er opnået som in vitro(under påvirkning af isoproterenol skete afslapningen af de menneskelige bronkier og segmenter af lungevævet), og in vivo(hurtigt fald i DP-resistens efter inhalation af en bronkodilatator).
Stimulering af b-adrenerge receptorer fører til aktivering af adenylatcyclase, som danner et kompleks med G-protein (fig. 1), under påvirkning af hvilket indholdet af intracellulært cyklisk adenosin-3,5-monophosphat (cAMP) stiger. Sidstnævnte fører til aktivering af en specifik kinase (proteinkinase A), som phosphorylerer nogle intracellulære proteiner, hvilket resulterer i et fald i intracellulær calciumkoncentration (dets aktive "pumpning" fra cellen ind i det ekstracellulære rum), hæmning af phosphoinositidhydrolyse, hæmning af myosin let kæde kinaser, og til sidst åbner store calciumaktiverede kaliumkanaler sig, hvilket forårsager repolarisering (afslapning) af glatte muskelceller og sekvestrering af calcium i det ekstracellulære depot. Det skal siges, at b 2 -agonister kan binde til kaliumkanaler og direkte forårsage afslapning af glatte muskelceller, uanset stigningen i intracellulær cAMP koncentration.
Fig.1. Molekylære mekanismer involveret i bronkodilaterende effekt af b 2 -agonister (forklaringer i teksten). K Ca - stor calciumaktiveret kaliumkanal; ATP - adenosintriphosphat; cAMP - cyklisk adenosin-3,5-monosphat
b 2 -agonister betragtes som funktionelle antagonister, der forårsager omvendt udvikling af bronkokonstriktion, uanset den forsnævre effekt, der har fundet sted. Denne omstændighed ser ud til at være yderst vigtig, da mange mediatorer (mediatorer af inflammation og neurotransmittere) har en bronkokonstriktor effekt.Som et resultat af påvirkningen af b-adrenerge receptorer lokaliseret i forskellige dele af DP (tabel 1), afsløres yderligere virkninger af b2-agonister, som forklarer muligheden for profylaktisk brug af lægemidler. Disse omfatter hæmning af frigivelsen af mediatorer fra inflammatoriske celler, et fald i kapillær permeabilitet (forhindrer udviklingen af ødem i bronkial mucosa), hæmning af kolinerg transmission (nedsættelse af kolinerg refleks bronkokonstriktion), modulering af slimproduktion af submucosale kirtler og, følgelig optimering af mucociliær clearance (fig. 2).
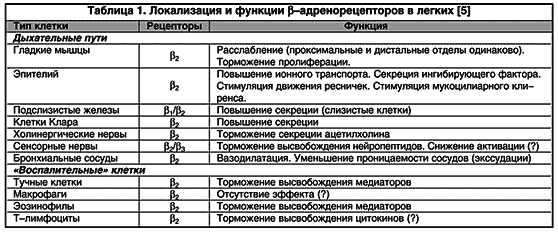

Ris. 2. Direkte og indirekte bronkodilaterende effekt af b 2 -agonister (forklaringer i teksten). E - eosinofil; TK - mastcelle; CN - kolinerg nerve; HmC - glat muskelcelle
Ifølge den mikrokinetiske diffusionsteori af G. Andersen er varigheden og tidspunktet for indtræden af virkningen af b 2 -agonister forbundet med deres fysisk-kemiske egenskaber (primært lipofilicitet / hydrofilicitet af molekylet) og egenskaberne ved virkningsmekanismen. Salbutamol - hydrofil forbindelse. Når det først er i det vandige medium i det ekstracellulære rum, trænger det hurtigt ind i "kernen" af receptoren og fjernes efter afslutningen af kommunikationen med den ved diffusion (fig. 3). Salmeterol , skabt på basis af salbutamol, et stærkt lipofilt lægemiddel, trænger hurtigt ind i membranerne af luftvejsceller, der udfører funktionen som et depot, og diffunderer derefter langsomt gennem receptormembranen, hvilket forårsager dens forlængede aktivering og en senere indtræden af virkning. Lipofilicitet formoterol mindre end salmeterols, derfor danner det et depot i plasmamembranen, hvorfra det diffunderer ind i det ekstracellulære miljø og derefter samtidig binder til b-adrenoreceptoren og lipider, hvilket bestemmer både hastigheden af virkningens indtræden og en stigning i sin varighed (fig. 3). Den langsigtede virkning af salmeterol og formoterol forklares ved deres evne til at forblive i dobbeltlaget af cellemembraner i glatte muskelceller i lang tid i umiddelbar nærhed af b 2 -adrenerge receptorer og interagere med sidstnævnte.

Ris. 3. Virkningsmekanisme for b 2 -agonister (forklaringer i teksten)
Når man forsker in vitro krampagtig muskel slapper hurtigere af ved tilsætning af formoterol end salmeterol. Dette bekræfter, at salmeterol er en partiel β2-receptoragonist i forhold til formoterol.
Racekammerater Selektive b 2 -agonister er racemiske blandinger (50:50) af to optiske isomerer - R og S. Det er blevet fastslået, at den farmakologiske aktivitet af R-isomerer er 20-100 gange højere end den for S-isomerer. R-isomeren af salbutamol har vist sig at udvise bronkodilaterende egenskaber. Samtidig udviser S-isomeren modsatte egenskaber: en pro-inflammatorisk virkning, en stigning i hyperreaktiviteten af DP, en stigning i bronkospasme, derudover metaboliseres den meget langsommere. For nylig er der blevet skabt et nyt lægemiddel, der kun indeholder R-isomeren ( levalbuterol
). Det findes indtil videre kun i en opløsning til forstøvere og har en bedre terapeutisk effekt end racemisk salbutamol, da levalbuterol udviser en ækvivalent effekt ved en dosis svarende til 25 % af den racemiske blanding (der er ingen antagonistisk S-isomer, og antallet af bivirkninger reduceres).
Selektivitet b 2 -agonister Formålet med anvendelsen af selektive b2-agonister er at tilvejebringe bronkodilatation og samtidig undgå uønskede hændelser induceret af stimulering af a- og b1-receptorer. I de fleste tilfælde fører moderat brug af b 2 -agonister ikke til udvikling af uønskede virkninger. Selektivitet kan dog ikke helt eliminere risikoen for deres udvikling, og det er der flere forklaringer på.
Først og fremmest er selektivitet for b2-adrenerge receptorer altid relativ og dosisafhængig. Let aktivering af a - og b 1 -adrenerge receptorer, umærkelig ved sædvanlige gennemsnitlige terapeutiske doser, bliver klinisk signifikant med en stigning i dosis af lægemidlet eller hyppigheden af dets administration i løbet af dagen. Den dosisafhængige effekt af b 2 -agonister skal tages i betragtning ved behandling af astmaeksacerbationer, især livstruende tilstande, når gentagne inhalationer i kort tid (flere timer) er 5-10 gange højere end den tilladte daglige dosis. .
b2-receptorer er bredt repræsenteret i DP (tabel 1). Deres tæthed stiger, når diameteren af bronkierne falder, og hos patienter med astma er tætheden af b 2 -receptorer i luftvejene højere end hos raske mennesker. Talrige b2-adrenerge receptorer findes på overfladen af mastceller, neutrofiler, eosinofiler og lymfocytter. Og samtidig findes b 2 -receptorer i forskellige væv og organer, især i venstre ventrikel, hvor de udgør 14% af alle b-adrenerge receptorer, og i højre atrium - 26% af alle b-adrenerge receptorer. receptorer. Stimulering af disse receptorer kan føre til udvikling af bivirkninger, herunder takykardi, atrieflimren og myokardieiskæmi. Stimulering af b2-receptorer i skeletmuskler kan forårsage muskelskælven. Aktivering af store kaliumkanaler kan bidrage til udvikling af hypokaliæmi og som følge heraf forlængelse af QT-intervallet og hjertearytmier, inkl. fatal. Ved systemisk administration af store doser lægemidler kan metaboliske virkninger (en stigning i niveauet af frie fedtsyrer i blodserum, insulin, glucose, pyruvat og laktat) observeres.
Når vaskulære b 2 -receptorer stimuleres, udvikles vasodilatation, og et fald i det diastoliske blodtryk er muligt. Uønskede hjerteeffekter er især udtalte ved tilstande med svær hypoxi under eksacerbationer af BA - en stigning i venøst tilbagevenden (især i orthopnea-positionen) kan forårsage udvikling af Bezold-Jarisch syndrom med efterfølgende hjertestop.
Sammenhæng mellem b 2 -agonister og betændelse i DP I forbindelse med den udbredte brug af korttidsvirkende b 2 -agonister, samt introduktionen i klinisk praksis af langvarige inhalerede b 2 -agonister, er spørgsmålet om, hvorvidt disse lægemidler har en antiinflammatorisk effekt, blevet særligt aktuelt. Uden tvivl kan den antiinflammatoriske virkning af b2-agonister, der bidrager til modifikationen af akut betændelse i bronkierne, betragtes som hæmning af frigivelsen af inflammatoriske mediatorer fra mastceller og et fald i kapillær permeabilitet. Samtidig fandt man ved en biopsi af bronkialslimhinden hos BA-patienter, der regelmæssigt tager b 2 -agonister, at antallet af inflammatoriske celler, inkl. og aktiveret (makrofager, eosinofiler, lymfocytter) falder ikke.
Samtidig kan regelmæssigt indtag af b 2 -agonister teoretisk set endda føre til forværring af inflammation i DP. Bronkodilatation forårsaget af b 2 -agonister giver således mulighed for en dybere vejrtrækning, hvilket kan resultere i en mere massiv eksponering for allergener.
Derudover kan regelmæssig brug af b 2 -agonister maskere den udviklende eksacerbation og derved forsinke påbegyndelsen eller intensiveringen af ægte antiinflammatorisk terapi.
Potentiel risiko ved brug b 2 -agonister Tolerance Hyppig regelmæssig brug af inhalerede b 2 -agonister kan føre til udvikling af tolerance (desensibilisering) over for dem. Akkumuleringen af cAMP bidrager til overgangen af receptoren til en inaktiv tilstand. Overdreven intens stimulering af b-adrenerge receptorer bidrager til udviklingen af desensibilisering (fald i receptorernes følsomhed som følge af afkobling af receptoren fra G-protein og adenylatcyclase). Mens overdreven stimulering opretholdes, falder antallet af receptorer på celleoverfladen ("nedregulering"). Det skal bemærkes, at b-receptorerne i de glatte muskler i DP har en ret betydelig reserve, og derfor er de mere modstandsdygtige over for desensibilisering end receptorerne i ikke-respiratoriske zoner (for eksempel skeletmuskler eller regulering af stofskiftet). Det er blevet fastslået, at raske individer hurtigt udvikler tolerance over for høje doser af salbutamol, men ikke over for fenoterol og terbutalin. Samtidig forekommer der sjældent tolerance over for den bronkodilaterende effekt af b 2 -agonister hos patienter med BA, tolerance over for deres bronchobeskyttende effekt udvikles meget oftere.
Faldet i den bronchobeskyttende virkning af b 2 -agonister med deres regelmæssige, hyppige brug gælder ligeligt for både korttidsvirkende og langvarige lægemidler, selv på baggrund af grundlæggende terapi med inhalerede kortikosteroider. Samtidig taler vi ikke om et fuldstændigt tab af bronkobeskyttelse, men om et lille fald i dets oprindelige niveau. H. J. van der Woude et al. fandt, at på baggrund af regelmæssig brug af formoterol og salmeterol hos patienter med astma, falder den bronkodilaterende virkning af sidstnævnte ikke, den bronchobeskyttende effekt er højere i formoterol, men den bronkodilaterende virkning af salbutamol er meget mindre udtalt.
Desensibilisering udvikler sig i lang tid, over flere dage eller uger, i modsætning til takyfylakse, som udvikler sig meget hurtigt og ikke er forbundet med receptorernes funktionelle tilstand. Denne omstændighed forklarer faldet i behandlingens effektivitet og kræver begrænsning af hyppigheden af brugen af b2-agonister.
Individuel variabilitet som respons på b2-agonister og udviklingen af tolerance over for deres bronkodilaterende effekt, forbinder mange forskere med genetisk polymorfi af gener. Det b2-adrenerge receptorgen er lokaliseret på 5q-kromosomet. En betydelig indvirkning på forløbet af BA og effektiviteten af behandlingen har en ændring i aminosyresekvensen af b2-adrenerge receptorer, især bevægelsen af aminosyrer i kodon 16 og 27. Indflydelsen af genpolymorfi strækker sig ikke til variabiliteten af den bronchobeskyttende effekt. Retfærdigvis skal det bemærkes, at disse data ikke er bekræftet i alle værker.
b 2 -agonister og dødelighed hos patienter med BA
Alvorlig tvivl om sikkerheden af inhalerede b-agonister opstod i 60'erne af det tyvende århundrede, da der i en række lande, herunder England, Australien, New Zealand, udbrød en "epidemi af dødsfald" blandt patienter med astma. Samtidig blev det antydet, at der var en sammenhæng mellem sympatomimetisk behandling og øget dødelighed af AD. En årsagssammenhæng mellem brugen af b-agonister (isoproterenol) og øget dødelighed blev ikke etableret på det tidspunkt, og det var næsten umuligt at bevise dem baseret på resultaterne af retrospektive undersøgelser. En sammenhæng mellem brug af fenoterol og en stigning i astmadødelighed i New Zealand i 1980'erne kunne bevises, da det viste sig, at dette lægemiddel blev ordineret oftere i tilfælde af dødelig astma sammenlignet med velkontrolleret sygdom. Denne sammenhæng blev indirekte bekræftet af faldet i dødeligheden, som faldt sammen med afskaffelsen af den udbredte anvendelse af fenoterol (med en generel stigning i salget af andre b 2 -agonister). I denne forbindelse er resultaterne af en epidemiologisk undersøgelse i Canada, som havde til formål at undersøge en mulig sammenhæng mellem hyppigheden af dødsfald og ordineret medicin, vejledende. Det har vist sig, at en stigning i forekomsten af dødsfald er forbundet med højdosisbehandling med en hvilken som helst af de tilgængelige inhalerede b 2 -agonister. Risikoen for dødelig udgang var højest med fenoterol, men ved bestilling sammenlignet med ækvivalente doser af salbutamol afveg dødelighedsraterne ikke signifikant.
Samtidig kan sammenhængen mellem højdosisbehandling med b 2 -agonister og en stigning i dødeligheden fra AD ikke pålideligt bevises, da patienter med mere alvorlig og dårligt kontrolleret AD er mere tilbøjelige til at ty til høje doser af b 2 - agonister og omvendt sjældnere ved hjælp af effektive antiinflammatoriske lægemidler. Desuden maskerer høje doser af b 2 -agonister tegn på en tiltagende fatal forværring af BA.
Doseringsregime Inhalerede korttidsvirkende b 2 -agonister Der er ingen tvivl om, at inhalerede korttidsvirkende b 2 -agonister er de foretrukne lægemidler til situationsbestemt symptomatisk kontrol af astma, samt til at forebygge udviklingen af symptomer på anstrengelsesinduceret astma (AFA). Regelmæssig brug af inhalerede b-agonister kan føre til tab af tilstrækkelig kontrol over sygdomsforløbet. I en undersøgelse af M.R. Sears et al. i New Zealand blev bronkial hyperresponsivitet, morgen-PSV, daglige symptomer og behovet for inhalerede kortikosteroider undersøgt hos patienter, der brugte on-demand b 2-agonister sammenlignet med patienter, der brugte fenoterol regelmæssigt 4 gange dagligt. I gruppen af patienter med regelmæssigt indtag af fenoterol blev der observeret dårlig kontrol af astmasymptomer, derudover blev hyppigere og alvorligere eksacerbationer noteret sammenlignet med gruppen af patienter, der brugte b 2 -agonister "on demand" i seks måneder. I sidstnævnte var der en forbedring i parametrene for funktionen af ekstern respiration, morgen PSV, et fald i responsen på en bronkoprovokationstest med metacholin. En stigning i bronkial hyperreaktivitet på baggrund af regelmæssig indtagelse af korttidsvirkende b 2 -agonister skyldes højst sandsynligt tilstedeværelsen af S-enantomerer i den racemiske blanding af lægemidlet.
Med hensyn til salbutamol kunne sådanne mønstre ikke etableres, selvom det, som i tilfældet med fenoterol, dets regelmæssige indtagelse blev ledsaget af en let stigning i bronkial hyperreaktivitet. Der er nogle beviser for, at regelmæssig brug af salbutamol er ledsaget af en stigning i hyppigheden af AFU-episoder og en stigning i sværhedsgraden af inflammation i DP.
Korttidsvirkende b 2 -agonister bør kun anvendes (også som en del af monoterapi) "on demand". Det er usandsynligt, at det almindeligt anbefalede doseringsregime for b 2 -agonister "on demand" kan forværre kontrollen i løbet af astma, men ved brug af høje doser af lægemidlet bliver forringelsen af kontrollen reel. Desuden bliver mange patienter særligt følsomme over for agonister i nærvær af polymorfi b2-adrenerge receptorer, hvilket fører til en hurtigere forringelse af kontrollen. Den etablerede sammenhæng mellem den øgede risiko for død hos patienter med astma og brugen af høje doser af inhalerede b 2 -agonister afspejler kun sygdommens sværhedsgrad. Det er også muligt, at høje doser af inhalerede b 2 -agonister har en skadelig virkning på forløbet af AD. Patienter, der får høje doser af b 2 -agonister (mere end 1,4 aerosoldåser pr. måned) har bestemt brug for effektiv antiinflammatorisk behandling, inkl. og for at reducere dosis af b2-agonister. Med en stigning i behovet for bronkodilatatorer (mere end tre gange om ugen) er en yderligere ordination af antiinflammatoriske lægemidler indiceret, og ved brug af b 2 -agonister mere end 3-4 gange om dagen for at lindre symptomer, en stigning i deres dosis er angivet.
Accept af korttidsvirkende b 2 -agonister med henblik på bronkobeskyttelse er også begrænset til "rimelige grænser" (ikke mere end 3-4 gange dagligt). De bronkobeskyttende egenskaber af b 2 -agonister gør det muligt for mange højt kvalificerede atleter, der lider af astma, at konkurrere på internationalt niveau (reglerne tillader brug af korttidsvirkende b 2 -agonister til forebyggelse af AFU, forudsat at sygdommen er medicinsk verificeret) . For eksempel deltog 67 AFU-atleter i de olympiske lege i 1984 i Los Angeles, hvoraf 41 modtog medaljer af forskellige pålydende. Det er kendt, at orale b 2 -agonister øger effektiviteten ved at øge muskelmassen, protein- og lipid-anabolisme og psykostimulering. I undersøgelsen af C. Goubart et al. det har vist sig, at effekten af inhalerede b 2 -agonister hos raske idrætsudøvere er begrænset til kun en let bronkodilatation, som dog kan yde et væsentligt bidrag til at forbedre respiratorisk tilpasning i begyndelsen af træningen.
Langtidsvirkende inhalerede b 2 -agonister
Aktuelt tilgængelige langvarige inhalerede b 2 -agonister - formoterol og salmeterol har deres virkning inden for 12 timer med en tilsvarende bronkodilatator effekt. Ikke desto mindre er der forskelle mellem dem. Først og fremmest er dette hastigheden af formoterol (i form af DPI), sammenlignelig med tidspunktet for indtræden af virkningen af salbutamol (i form af PAI), som tillader brugen af formoterol som ambulance i stedet for kort- fungerende b 2 -agonister. Samtidig er bivirkninger ved brug af formoterol signifikant mindre end ved brug af salbutamol. Disse lægemidler kan bruges som monoterapi til patienter med mild astma som bronchobeskyttere i AFU. Ved brug af formoterol mere end 2 gange om ugen "on demand", er det nødvendigt at tilføje ICS til behandlingen.
Det skal bemærkes, at monoterapi med langtidsvirkende β 2 -agonister på regelmæssig basis ikke anbefales, da der stadig ikke er pålidelige beviser for deres antiinflammatoriske, sygdomsmodificerende virkning.
Der er evidensbaseret evidens for tilrådeligheden af kombineret brug af ICS og bronkodilatatorer. Kortikosteroider øger ekspressionen af b2-receptorer og reducerer potentiel desensibilisering, mens langvarige b2-agonister øger kortikosteroidreceptorernes følsomhed over for ICS.
Undersøgelser udført til dato indikerer muligheden for en tidligere udnævnelse af langvarige inhalerede b 2 -agonister. Så for eksempel hos patienter med utilstrækkelig astmakontrol, mens de tager 400-800 µg ICS, giver den yderligere administration af salmeterol mere fuldstændig og tilstrækkelig kontrol sammenlignet med en stigning i dosis af ICS. Formoterol viser en lignende effekt og hjælper samtidig med at reducere hyppigheden af forværringer af sygdommen. Disse og flere andre undersøgelser tyder på, at tilsætning af langtidsvirkende inhalerede b 2 -agonister til lav-middeldosis ICS-behandling hos patienter med utilstrækkelig astmakontrol svarer til en fordobling af dosis af steroider.
I øjeblikket anbefales det kun at bruge langvarige inhalerede b 2 -agonister til patienter, der samtidig får ICS. Faste kombinationer såsom salmeterol med fluticason (Seretide) og formoterol med budesonid (Symbicort) virker lovende. Samtidig noteres bedre compliance, risikoen for kun at bruge et af lægemidlerne inden for rammerne af langtidsbehandling af sygdommen er udelukket.
Litteratur:1. National Institutes of Health, National Heart, Lung, and Blood Institute. Ekspertpanelrapport 2: Retningslinjer for diagnosticering og behandling af astma. Bethesda, Md: National Institutes of Health, National Heart, Lung, and Blood Institute; april 1997. NIH-publikation 97-4051.
2. Lawrence D.R., Benitt P.N. Klinisk farmakologi. I 2 bind. Moskva: Medicin; 1991
3. Mashkovsky M.D. Lægemidler. Moskva: Medicin; 1984
4. Vis M. B2-agonister, fra farmakologiske egenskaber til daglig klinisk praksis. International workshoprapport (baseret på en workshop afholdt i London, Storbritannien 28.-29. februar 200)
5 Barnes P.J. b-agonister, antikolinergika og andre ikke-steroide lægemidler. I: Albert R., Spiro S., Jett J., redaktører. Omfattende respiratorisk medicin. Storbritannien: Harcourt Publishers Limited; 2001.s.34.1-34-10
6. Opdatering af retningslinjer om astma hos voksne (redaktionelt). BMJ 2001; 323:1380-1381.
7. Jonson M. b 2 -adrenoceptoragonister: optimal farmakologisk profil. I: Rollen af b 2 -agonister i astmabehandling. Oxford: Medicingruppen; 1993.s. 6-8.
8 Barnes P.J. beta-adrenerge receptorer og deres regulering. Am J Respir Crit Care Med. 1995; 152:838-860.
9. Kume H., Takai A., Tokuno H., Tomita T. Regulering af Ca2+-afhængig K+-kanalaktivitet i tracheale myocytter ved phosphorylering. Nature 1989; 341:152-154.
10 Anderson G.P. Langtidsvirkende inhalerede beta-adrenoceptoragonister: den sammenlignende farmakologi af formoterol og salmeterol. Agents Actions Suppl. 1993; 43:253-269.
11. Stiles GL, Taylor S, Lefkowitz RJ. Humane hjerte-beta-adrenerge receptorer: subtype heterogenitet afgrænset af direkte radioligandbinding. livsvidenskab. 1983; 33:467-473.
12. Prior JG, Cochrane GM, Raper SM, Ali C, Volans GN. Selvforgiftning med oral salbutamol. BMJ. 1981; 282:1932.
13. Handley D. Den astma-lignende farmakologi og toksikologi af (S)-isomerer af beta-agonister. J Allergiklinik Immunol. 1999;104: S69-S76.
14. Jonson M., Coleman R. Virkningsmekanismer beta-2-adrenoceptoragonister. I: Bisse W., Holgate S., editorials. Astma og rhinitis. Blackwell Science; 1995. s. 1278-1308.
15. Burggsaf J., Westendorp R.G.J., in't Veen J.C.C.M et al. Kardiovaskulære bivirkninger af inhaleret salbutamol hos hypoxiske astmatiske patienter. Thorax 2001; 56:567-569.
16. Van Shayck C.P., Bijl-Hoffland I.D., Closterman S.G.M. et al. Potentiel maskerende effekt på dispnøopfattelse af kort- og langtidsvirkende b 2 -agonister ved astma. ERJ 2002; 19:240-245.
17. Van der Woude H.J., Winter T.N., Aalbers R. Nedsat bronchodilaterende effekt af salbutamol til lindring af methacholin induceret moderat til svær bronkokonstriktion under højdosisbehandling med langtidsvirkende b2-agonister. Thorax 2001; 56:529-535.
18. Nelson H.S. Klinisk erfaring med levalbuterol. J Allergiklinik Immunol. 1999; 104:S77-S84.
19. Lipworth BJ, Hall IP, Tan S, Aziz I, Coutie W. Effekter af genetisk polymorfi på ex vivo og in vivo funktion af b2-adrenoceptorer hos astmatiske patienter. Chest 1999;115:324-328.
20. Lipworth BJ, Kopelman G.H., Wheatley A.P. et al. b 2 -adrenoceptor promotor polymorfi: udvidede halotyper og funktionelle effekter i perifere blod mononukleære celler. Thorax 2002; 57:61-66.
21. Lima JJ, Thomason DB, Mohamed MH, Eberle LV, Self TH, Johnson JA. Indvirkning af genetiske polymorfismer af den b2-adrenerge receptor på albuterol bronkodilatator farmakodynamik. Clin Pharm Ther 1999; 65:519-525.
22. Kotani Y, Nishimura Y, Maeda H, Yokoyama M. b 2 -adrenerge receptorpolymorfier påvirker luftvejenes reaktion på salbutamol hos astmatikere. J Asthma 1999; 36:583-590.
23. Taylor D.R., Sears M.R., Cockroft D.W. Beta-agonist-kontroversen. Med Clin North Am 1996; 80:719-748.
24. Spitzer WO, Suissa S, Ernst P, et al. Brugen af beta-agonister og risikoen for død og nær død af astma. N Engl J Med 1992; 326:501-506.
25. Sears MR, Taylor DR, Print CG, et al. Regelmæssig inhaleret beta-agonistbehandling ved bronkial astma. Lancet 1990; 336:1391-1396.
26. Handley D. Den astma-lignende farmakologi og toksikologi af (S)-isomerer af beta-agonister. J Allergiklinik Immunol. 1999; 104:S69-S76.
27. Nelson H.S. Klinisk erfaring med levalbuterol. J Allergy Clin Immunol 1999;104:S77-S84.
28. Liggett S.B. Polymorfismer af den b2-adrenerge receptor ved astma. Am J Respir Cri. Care Med 1997; 156:S 156-162.
29. Voy R.O. Den amerikanske olympiske komités erfaring med anstrengelsesudløst bronkospasme. Med Sci Exerc 1986; 18:328-330.
30. Lafontan M, Berlan M, Prud'hon M. Les agonistes beta-adrenergiques. Virkningsmekanismer: lipomobilisering og anabolisme. Reprod Nutr Develop 1988; 28:61-84
31. Martineau L, Horan MA, Rothwell NJ, et al. Salbutamol, en b2-adrenoceptoragonist, øger skeletmuskelstyrken hos unge mænd. ClinSci 1992; 83:615-621.
32 Pris AH, Clissold SP. Salbutamol i 1980'erne. En revurdering af dens kliniske effekt. Drugs 1989; 38:77-122.
33. Goubault C, Perault M-C, Leleu et al. Effekter af inhaleret salbutamol i motionerende ikke-astmatiske atleter Thorax 2001; 56:675-679.
34. Seberova E, Hartman P, Veverka J, et al. Formoterol givet af Turbuhaler® havde en hurtig indsættende virkning som salbutamol givet af pMDI. Program og abstracts fra 1999 International Conference of American Thoracic Society; 23-28 april 1999; San Diego, Californien Abstrakt A637.
35. Wallin A., Sandstrom T., Soderberg M. et al. Virkningerne af almindelig inhaleret formoterol, budesonid og placebo på slimhindebetændelse og kliniske indeks for mild astma. Am J Respir Crit Care Med. 1998; 158:79-86.
36. Greening AP, Ind PW, Northfield M, Shaw G. Tilføjet salmeterol versus højere dosis kortikosteroid hos astmapatienter med symptomer på eksisterende inhaleret kortikosteroid. Allen & Hanburys Limited UK Study Group. Lancet. 1994; 334:219-224.
Side 8 af 8
Behandling af patienter med astma udføres i lang tid, normalt hele livet. Samtidig skal det huskes, at lægemiddelbehandling ikke erstatter foranstaltninger, der forhindrer patienten i at komme i kontakt med allergener og irriterende stoffer. Tilgangen til behandlingen af en bestemt patient afhænger af hans tilstand og det mål, som lægen står over for i øjeblikket. I praksis er det nødvendigt at skelne mellem følgende behandlingsmuligheder:
- lindring af et angreb;
- eksacerbationsbehandling;
- grundlæggende anti-tilbagefaldsterapi;
- behandling af status asthmaticus.
For at stoppe et angreb
astma bruges bronkodilatatorer lægemidler (bronkodilatatorer), der anvendes uafhængigt af patienten situationsbestemt i form af en doseret aerosolanordning (f.eks. salbutamol til milde luftvejslidelser) eller af medicinsk personale gennem en forstøver (ved alvorlige luftvejslidelser).
Til behandling af en eksacerbation
tilgang anbefales træde ned"– (fra top til bund) efter skemaet trinvis tilgang til behandling af astma.
Grundlæggende anti-tilbagefaldsterapi
udføres ved regelmæssig brug af en vedligeholdelsesdosis af antiinflammatoriske lægemidler, hvoraf de mest effektive er inhalerede glukokortikoider(IGK).
Behandling af status asthmaticus
administreres i høje doser systemiske glukokortikoider intravenøst (IGC) og bronkodilatatorer ved korrektion af syre-base stofskifte og blodgassammensætning ved hjælp af medicin og ikke-farmakologiske midler.
Ordningen med den trinvise tilgang til behandling af astma letter i høj grad lægens opgave og minimerer taktiske fejl i håndteringen af patienten.
SKEMA MED EN TRINVIS TILGANG TIL AT OPNÅ OG VEDLIGEHOLDE ASTHMAKONTROL.
På alle stadier af behandlingen bør en hurtigtvirkende inhaleret β2-agonist* bruges til at lindre akutte symptomer, dog ikke mere end 3-4 gange dagligt.
Alvorlighed |
Daglig medicin til sygdomsbekæmpelse |
Alternative behandlingsmuligheder** |
|
Intermitterende astma*** |
Ikke nødvendigt |
|
|
Vedvarende mild astma |
ICS £500 mcg beclomethasondipropionat eller tilsvarende |
1. Theophyllin vedvarende frigivelse eller 2. Cromon el |
|
Vedvarende moderat astma |
ICS 200 - 1000 mcg beclomethasondipropionat eller tilsvarende + langtidsvirkende inhaleret β2-agonist |
1. ICS 500 - 1000 mcg beclomethasondipropionat eller tilsvarende + theophyllin med vedvarende frigivelse eller 2. ICS 500-1000 mcg beclomethasondipropionat eller tilsvarende + langtidsvirkende oral β2-agonist eller 3. Højdosis ICS (>1000 mcg beclomethasondipropionat eller tilsvarende) eller 4. ICS 500-1000 mcg beclomethasondipropionat eller tilsvarende + leukotrienmodulator |
|
Svær vedvarende astma |
ICS 200 - 1000 mcg beclomethasondipropionat eller tilsvarende + langtidsvirkende inhaleret β2-agonist + om nødvendigt en af følgende: Theophyllin vedvarende frigivelse; |
Alle stadier: Efter at have opnået astmakontrol og vedligeholdt den i mindst 3 måneder, bør du forsøge gradvist at reducere dosis af vedligeholdelsesbehandling for at fastlægge de minimumsdoser og antal lægemidler, der kræves for at opretholde kontrol.
* - andre muligheder for nødhjælp (i stigende rækkefølge af omkostninger) er: inhaleret antikolinerg medicin, korttidsvirkende oral b2-agonist;
** - andre behandlingsmuligheder betragtes som alternativer og er opført i stigende rækkefølge efter omkostninger;
*** - Patienter med intermitterende astma, som har en ikke-alvorlig eksacerbation, skal, når de ordinerer terapi, anses for at have vedvarende astma af moderat sværhedsgrad.
Bemærk:
1. Hyppigheden af brug af korttidsvirkende b2-agonister 3-4 gange dagligt er et af hovedkriterierne for evaluering af effektiviteten af antiinflammatorisk terapi. En yderligere stigning i behovet for b2-agonister indikerer behovet for at øge dosis af antiinflammatoriske lægemidler.
2. Alle inhalerede lægemidler skal administreres gennem en spacer, hvilket øger deres effektivitet og reducerer risikoen for bivirkninger.
Der er to tilgange til at ordinere antiinflammatoriske lægemidler, især ICS.
En tilgang" blive bedre"- "bottom up", indebærer udnævnelse af minimale doser af IGK for et givet stadium, efterfulgt af en stigning, indtil en klinisk effekt opnås, eller en erstatning for et lægemiddel med en mere udtalt antiinflammatorisk aktivitet.
En tilgang" træde ned"-" fra top til bund" indebærer udnævnelsen af den maksimale dosis af antiinflammatorisk lægemiddel til dette stadie, efterfulgt af en dosisreduktion til den minimale vedligeholdelsesdosis, hvilket sikrer, at patienten opretholder kriterierne for velkontrolleret astma. "Step down"-tilgangen er at foretrække, da den muliggør hurtigere eliminering af de kliniske symptomer på sygdommen, reducerer tiden til at opnå remission, fører til et fald i den samlede mængde af lægemidlet pr. behandlingsforløb af en eksacerbation og reducerer udgifterne til behandlingen.
Et eksempel på tilgangen træde ned”er udnævnelsen af SGC i henhold til ”rednings”-kurset i behandlingen af alvorlig forværring af vedvarende astma. Typisk gives prednisolon 30-60 mg/dag (eller en ækvivalent dosis af et andet lægemiddel) som en enkelt dosis i 2-5 dage, efterfulgt af nedtrapning eller stop af lægemidlet, når tilstanden stabiliserer sig. IGCS ordineres samtidig med SGC'er, da den kliniske effekt af deres anvendelse manifesteres efter flere dages behandling: efter 3-5 dage med fluticason og efter 7-10 dage med beclomethason.
Hvis en patient bruger en ICS, men der er kliniske eller funktionelle tegn på nedsat astmakontrol (f.eks. på grund af et viralt angreb), bør dosis af lægemidlet automatisk øges med 2-3 gange fra originalen, indtil symptomerne er fuldstændige forsvinde.
En anden mulighed for behandling af eksacerbation i henhold til ordningen " træde ned»baseret på brug af kombinationsterapi: langtidsvirkende b2-agonist + IGK. For eksempel, seretide(250 mikrogram fluticason + 50 mikrogram salmeterol) 2 gange dagligt, indtil de kliniske og funktionelle tegn på astma er fuldstændig elimineret. På grund af synergismen af salmeterol og fluticason vil den kliniske effekt af dette lægemiddel svare til udnævnelsen af fluticason i en dosis på 1000 mcg / dag, hvilket fører til hurtig eliminering af kliniske tegn på sygdommen.
Ændring af det eksisterende behandlingsregime i retning af at øge dosis af antiinflammatoriske lægemidler udføres med en forværring af astma. Hvori kriterier for forværring af sygdommen bør overvejes:
- en stigning i behovet for korttidsvirkende b2-agonister i mere end 4 inhalationer inden for de foregående 24 timer (sammenlignet med sædvanlige doser);
- en stigning i hyppigheden af astmasymptomer, kombineret med et fald i peak expiratory flow (PEF), målt om morgenen, mere end > 20 % af den individuelle norm, i 3 eller flere dage.
PRINCIPPER OG METODER TIL BEHANDLING AF STATUS ASTHMATISKE
Astmatisk status er en indikation for øjeblikkelig indlæggelse og intensiv pleje af patienten.
Kompleks terapi for AS omfatter:
- intravenøs administration af HA;
- indførelse af korttidsvirkende b2-agonister (salbutamol) gennem en forstøver;
- intravenøst dryp af methylxanthiner (aminofyllin);
- infusionsbehandling;
- med anafylaktisk form - parenteral administration af adrenalin;
- iltbehandling;
- med hypoventilation og hyperkapni - mekanisk ventilation;
- med tilføjelse af en bakteriel infektion - antibakterielle lægemidler.
Systemiske glukokortikoider (SGK) er de grundlæggende lægemidler til AS. Deres anvendelse skal være styret af følgende principper:
- høje doser er mere effektive end lave doser;
- introduktionen bør påbegyndes straks;
- en ladningsdosis af prednisolon er ca. 8 mg/kg legemsvægt (men ikke mindre end 120 mg) som en bolus, derefter administreres hver 3.-6. time 2 mg/kg indtil klinisk bedring; derefter reduceres dosis gradvist (med 25-30% pr. dag) til minimum vedligeholdelse;
- SGC-terapi per os udføres med en hastighed på 0,5 mg / kg prednisolon, efterfulgt af en gradvis dosisreduktion;
- terapi kan udføres med andre GC'er i ækvivalente doser;
- i en ekstremt alvorlig tilstand af patienten og den lave effektivitet af disse terapeutiske foranstaltninger udføres pulsbehandling med methylprednisolon (1000 mg).
b 2-korttidsvirkende agonister(oftest salbutamol) indgives ved inhalation som en aerosol ved hjælp af en forstøver (en anordning til at omdanne væske til en aerosol med en partikelstørrelse på 3-5 mikron). Samtidig opnås forlængelse af inhalationen, der er ikke behov for obligatorisk inhalationssynkronisme, og patienternes luftveje fugtes. Dosis af salbutamol i opløsning til inhalationsterapi er 2,5-5 mg 3-4 gange dagligt.
Aminofyllin (eufillin), tilhører gruppen af methylxanthiner, er stadig et værktøj, der aktivt bruges i AS:
- den indledende dosis af aminophyllin - 5-6 mg / kg IV langsomt (over 20 minutter);
- yderligere - 1,0 mg / kg / time hver 1-2 timer;
- derefter 0,7-1,3 mg / kg / t, indtil tilstanden forbedres;
- den maksimale daglige dosis af aminophyllin bør ikke overstige 2,0 g med konstant overvågning af hjerteaktivitet på grund af truslen om arytmier;
- terapeutisk koncentration af theophyllin i blodet - 10-20 mcg / ml.
Iltbehandling til behandling af AS:
- indiceret i tilfælde af arteriel hypoxæmi (PaO2 mindre end 60 mm Hg);
- koncentrationen af O2 i den indåndede luft er normalt 30-35%;
- hastigheden af O2-inhalationer er 1,0-5 l/min, under kontrol af arteriel blodgasometri 20-30 minutter efter starten af iltbehandling, hvilket forhindrer en stigning i PaCO2 med mere end 10% og et fald i pH mindre end 7,25.
Iltbehandling anses for at være effektiv, hvis niveauet af PaO2 er mere end 80 mm Hg. Kunst. og CO2 over 90%.
I nærvær af tegn på en bronkial infektion og fravær af allergiske reaktioner er antibiotikabehandling ordineret.
Hjælpekunstig ventilation af lungerne(AVL) er indiceret i tilfælde af vedvarende arteriel hypoxæmi (PaO2 mindre end 60 mm Hg), progression af arteriel hyperkapni under iltbehandling samt ved alvorlig træthed af de respiratoriske muskler. For at forhindre eksspiratorisk kollaps af små bronkier, reducere overdreven energiforbrug ved vejrtrækning hos patienter med et højt niveau af spontant positivt slutekspiratorisk tryk, anbefales det at eksternt positivt endeekspiratorisk tryk(PEEP) inden for 5-9 cm vand. Kunst. under kontrol af hæmodynamiske parametre.
Opløsningen af AS som et resultat af tilstrækkelig terapi sker som regel inden for et par timer fra behandlingens start: tyktflydende sputum begynder at adskille, hvis mængde stiger betydeligt på baggrund af intensiv hydrering i kombination med inhalation af O2 , puls, blodtryk, respiration, PaO2 normaliseres.
Døden i AS kan være lægers taktiske fejl:
- sen og utilstrækkelig udnævnelse af civilloven;
- udnævnelsen af beroligende midler, som deprimerer åndedrætscentret og fører til respirationsstop;
- overdreven infusionsbehandling;
- øget bronkospasme under sanitetsbronkoskopi;
- progression af bronkopulmonal infektion på baggrund af mekanisk ventilation.
ASTMAKONTROLLER
Der tages lægemidler, der styrer sygdomsforløbet daglige og i lang tid, som giver dig mulighed for at opnå og vedligeholde remission af astma. Disse omfatter antiinflammatoriske lægemidler: inhalerede og systemiske glukokortikoider, cellemembranstabilisatorer, antileukotrienlægemidler og langtidsvirkende bronkodilatatorer(langtidsvirkende theofylliner, langtidsvirkende b2-agonister).
INDÅNDING GLUCOCORTICOIDS
Inhalerede GC'er er i øjeblikket de vigtigste lægemidler til den grundlæggende behandling af astma. Anvendelsen af regeringskonferencen er baseret på kraftig lokal anti-inflammatorisk virkning, hvis konsekvens er eliminering (eller en væsentlig reduktion) af de kliniske symptomer på sygdommen, forbedring af lungefunktionen, reduktion af bronkial overfølsomhed, sværhedsgraden af eksacerbationer og som følge heraf forbedring af livskvaliteten .
Inhalerede GC'er kan ikke bruges til at lindre et astmaanfald, da deres virkning udvikler sig langsomt over 1 uge, og den maksimale effekt noteres efter ca. 6 uger fra behandlingsstart.
Til inhalation anvendes beclomethason, flunisolid, budesonid, triamcinalonacetonid og fluticason.
Farmakodynamik.
IGK'er har en udtalt lokal anti-inflammatorisk virkning, som er baseret på et fald i syntesen og frigivelsen af leukotriener og prostaglandiner; hæmning af cytokinproduktion; hæmning af aktivering af adhæsionsmolekyler; fald i kapillær permeabilitet; forebyggelse af direkte migration og aktivering af inflammatoriske celler. Derudover reducerer IG'er bronkialtræets hyperreaktivitet, øger antallet og følsomheden af b2-receptorer i bronkiernes glatte muskler og svækker også den parasympatiske (M-cholinerge) stimulering af bronkierne.
Farmakokinetik.
Ved indånding når kun 10-20% af HA luftvejene og har en lokal anti-inflammatorisk effekt. De resterende 80-90% tilbageholdes i mundhulen og sluges derefter. Når du bruger en spacer, øges graden af indtrængning af lægemidlet i bronkierne. Efter absorption i mave-tarmkanalen gennemgår en betydelig del af lægemidlet first pass metabolisme i leveren. Systemisk biotilgængelighed varierer afhængigt af typen af lægemiddel: for flunisolid er det omkring 20%, for budesonid - 10%, for beclomethason< 5%, у флутиказона менее 1%.
Glukokortikoider adskiller sig i deres anti-inflammatoriske aktivitet og biotilgængelighed efter inhalationsadministration. Sammenligning af doser af forskellige ICS'er er vanskelig på grund af deres forskellige virkningsvarighed og dosis-responskurvernes relativt "flade" karakter. Så med omtrent tilsvarende klinisk effekt kan 500 µg flunisolid erstattes af 200 µg beclomethasondipropionat eller 100 µg fluticasonpropionat.
Bivirkninger
.
IGCS forårsager praktisk talt ikke systemiske reaktioner, der er forbundet med orale lægemidler. Kun ved længere tids brug i høje daglige doser kan de have en let hæmmende effekt på hypothalamus-hypofyse-binyresystemet.
Lokale reaktioner sjældent observeret:
- Dysfoni (<2%), обусловленная миопатией мышц гортани, обратима и проходит при отмене.
- Oropharyngeal candidiasis (<2%). Факторами риска являются пожилой возраст, ингаляции более 2 раз в день, одновременное назначение антибиотиков и/или СГК внутрь.
- Sporadisk hoste på grund af irritation af de øvre luftveje (<4%).
Forebyggende foranstaltninger: brugen af lægemidlet før måltider, skylning af mund og svælg efter inhalation, brug af en spacer.
KOMBINATIONSTERAPI
En af de mulige måder at øge effektiviteten af behandlingen af patienter med astma, herunder svær astma, er brugen af kombineret terapi. I øjeblikket er den mest effektive kombination anerkendt som kombinationen af ICS + langtidsvirkende inhaleret b2-agonist. En stigning i effektiviteten af behandlingen med denne kombination opnås på grund af de særlige forhold ved virkningsmekanismen for hvert af lægemidlerne såvel som deres synergisme: den langtidsvirkende b2-agonist præaktiverer steroidreceptoren, og IHC øger følsomheden af b-receptoren til b-agonisten.
Et eksempel på et lægemiddel til kombinationsterapi er seretide
, bestående af fluticasonpropionat og salmeterol, fås som aerosol- og pulverinhalator med afmålt dosis med dosistæller. Seretide er overlegen med hensyn til effekt i forhold til fluticason og salmeterol administreret alene. Med hensyn til klinisk effekt svarer tilsætning af 50 μg salmeterol til fluticason til en fordobling af dosis af sidstnævnte.
Dosering
udføres af fluticason og afhænger af sværhedsgraden af astma. Tilgængelig i form af afmålte aerosoler (fluticason 50, 125 og 250 mcg + salmeterol 25 mcg) og også som multidoseringsenhed (fluticason 100, 250 og 500 mcg + salmeterol 50 mcg).
SYSTEMISKE GLUCOCORTICOIDS
Langvarig oral behandling med systemiske glukokortikoider kan være påkrævet for at kontrollere svær vedvarende astma.
I nogle tilfælde tyer de til udnævnelsen af et "besparende" kursus af SGC inde. Indikationer for at gennemføre et "redningskursus" er:
- progressiv forværring af patientens tilstand og fald i FEV1;
- fald i FEV1 under 60% af normen;
- søvnforstyrrelser forårsaget af astma;
- vedvarende morgensymptomer hele dagen;
- nedsat effektivitet af inhalerede bronkodilatatorer;
- behovet for at administrere b2-agonister ved hjælp af en stationær inhalator eller injektioner.
I de fleste tilfælde skal GCS tages som en morgendosis især for langtidsvirkende lægemidler. Den anden mulighed er at tage det meste af lægemidlet (2/3 - 3/4) om morgenen og den resterende mindre del omkring kl. Indtagelse af SHA om morgenen reducerer risikoen for depression af hypothalamus-hypofyse-binyresystemet (HPA) og udvikling af osteoporose, da HPA om morgenen er den mindst følsomme over for den undertrykkende effekt af eksogene GC'er.
CELLEMMBRANSTABILISATORER
Membranstabilisatorer er natriumchromoglykat, nedocromilnatrium og ketotifen.
- natriumchromoglykat og nedocromilnatrium kan bruges som et alternativ til b2-agonister for at forhindre anstrengelsesinduceret astma;
- hos børn<12 лет и у взрослых c легким течением астмы недокромил натрия может являться альтернативой низким дозам ИГК, не обладая присущими последним нежелательными реакциями;
- Ketotifen anbefales ikke til behandling af astma.
ANTILEUKOTRIENE stoffer
Denne gruppe repræsenterer en ny generation af orale antiinflammatoriske lægemidler til langtidsbehandling af astma. Det inkluderer 5-lipoxygenasehæmmeren zileuton samt leukotrienreceptorblokkere til cysteinylleukotrien - zafirlukast og montelukast.
- leukotrienreceptorantagonister (ALR'er) er et alternativ til stigende doser af ICS i tilfælde af utilstrækkelig kontrol over astmaforløbet;
- ALR'er kan bruges med mellemstore og høje doser af ICS;
- er ikke førstevalgslægemidler til patienter med astma, men hos patienter, der ikke kan tage GC'er, er de de foretrukne lægemidler;
- ALR er indiceret til patienter med aspirinastma.
LANGVIRKEENDE BRONKODILATERE
Langtidsvirkende bronkodilatatorer omfatter langtidsvirkende b2-agonister, langtidsvirkende theophyllinpræparater og til dels M-antikolinergika.
Langtidsvirkende beta2-agonister
Denne gruppe omfatter to lægemidler - salmeterol og formoterol, som er karakteriseret ved høj selektivitet for b2-adrenerge receptorer.
Farmakodynamik.
Virkningsmekanismen for langtidsvirkende b2-agonister på receptorniveau adskiller sig fra korttidsvirkende b2-agonisters. Den vigtigste er lipofilicitet af salmeterol og formoterol. På grund af den høje lipofilicitet trænger salmeterol hurtigt ind i cellemembranerne i luftvejene, hvor det aflejres, hvilket reducerer hastigheden af lægemiddellevering til glatte muskler og funktionelle b2-receptorer. Formoterol har en lavere lipofilicitet sammenlignet med salmeterol, så en betydelig del af lægemidlet forbliver i den vandige fase og trænger hurtigere ind til b2-receptorerne i luftvejenes glatte muskler, hvilket giver en hurtigere bronkodilaterende effekt.
Langtidsvirkende theophyllinpræparater
Langtidsvirkende theofylliner er hovedtypen af methylxanthiner, der bruges til langtidsbehandling af astma. Der findes et stort antal forskellige langvarige theophyllinpræparater (teopec, teotard, retafil osv.). De har en moderat bronkodilaterende effekt, stimulerer mucociliær clearance og har en moderat anti-inflammatorisk effekt. Ekstrapulmonære effekter manifesteres ved en stigning i kontraktiliteten af mellemgulvet og interkostale muskler samt en stimulerende effekt på åndedrætscentret.
Applikationsfunktioner
. Doser af forlængede theofylliner vælges individuelt. På den 4. dag fra starten af behandlingen skal effektiviteten af den indledende dosis evalueres (voksne - 400 mg / dag, børn 16 mg / kg / dag). Det er optimalt at tage 1/3 af dosis om morgenen eller ved middagstid og 2/3 af den daglige dosis om aftenen. Behandling med theophyllinpræparater bør udføres under overvågning af terapeutisk lægemiddelovervågning.
stoffer, der bruges til at lindre bronkial ASTMA
korttidsvirkende b2-agonister
I øjeblikket bruges korttidsvirkende selektive b2-agonister - salbutamol, fenoterol, terbutalin - som førstevalg til at stoppe episoder med bronkospasme. Sammenlignet med ikke-selektive sympatomimetika er de meget mindre tilbøjelige til at forårsage bivirkninger fra det kardiovaskulære system på grund af stimulering af b1-receptorer. Selektiviteten for b2-receptorer reduceres dog væsentligt ved ordinering af store doser lægemidler, ved oral og parenteral administration samt ved hypoxi.
Plads i terapi
.
korttidsvirkende b2-agonister er indiceret til næsten alle patienter til lindring af astmaanfald.
Den manglende effekt af hjemmebrug af korttidsvirkende b2-agonister kan oftest forklares med utilstrækkelige mængder af lægemidler, der trænger ind i tracheobronchial-træet ved brug af traditionelle leveringsmidler (DAU) eller oftest ved forkert inhalatorteknik.
Et fald i lægemidlets effektivitet kan udvikle sig som følge af beskadigelse af receptorerne ved en virusinfektion. En mulig årsag til dysreguleringen af b2-receptorer er også det hyppige regelmæssige indtag af b2-agonister, hvorved deres bronkodilaterende effekt aftager. Paradoksale reaktioner på brugen af b2-agonister, dvs. bronkospastisk effekt, observeret meget sjældent.
Ifølge American Academy of Allergy and Immunology er øget brug af b2-agonister (mere end 200 doser pr. måned) en markør for svær astma, og sådanne patienter kræver yderligere antiinflammatorisk behandling (HA).
Administrationsveje og leveringsmåder.
Succesen med bronkial astmaterapi afhænger ikke kun af det korrekte valg af lægemidlet, dets dosis, men også af den passende levering af lægemidlet til luftvejene. Sympatomimetika kan ordineres ved inhalation, parenteralt og oralt, indgivelsesvejen til inhalation foretrækkes imidlertid. Succesen med terapi afhænger af inhalationsteknikken. Børn og ældre patienter er som regel ikke i stand til korrekt at mestre og koordinere respirationsmanøvren. De anbefales at bruge specielle enheder - afstandsstykker. Brugen af en spacer øger lægemidlets indtrængning i luftvejene (op til 7-14 gange ved alvorlig astmaforværring). En anden effektiv måde at administrere lægemidlet på er indånding gennem en forstøver(en enhed, der omdanner en flydende doseringsform af et lægemiddel til en aerosol).
Inhalationsterapi med pulverinhalatorer. Eksisterer pulver former lægemidler, der indføres i luftvejene ved hjælp af specielle enheder - dishalere, turbuhalere, multidisk. I dette tilfælde aktiveres strømmen af lægemidlet ved patientens indånding. Den mest avancerede pulverinhalator er i øjeblikket multidisk. Den er åndedrætsaktiveret, har dosistæller, afgiver en stabil dosis, trænger op til 30 % af dosis ind i luftvejene, er beskyttet mod fugt, skaber lav luftstrømsmodstand og kan bruges til patienter med svær obstruktion, børn fra 3 år og ældre patienter.
stoffer
Salbutamol
En af de mest selektive korttidsvirkende b2-agonister. Kan indgives oralt og parenteralt, men inhalationsvejen bør foretrækkes. Ved inhalation udvikles den bronkodilaterende effekt efter 4-5 minutter, den maksimale effekt er efter 40-60 minutter, varigheden er 4-6 timer. Efter oral administration nås det maksimale niveau i blodet efter 2 timer.
Dosering:
indånding ved hjælp af DI (100 mcg / åndedræt) 1-2 vejrtrækninger ikke mere end 6 gange om dagen; ved hjælp af en forstøver, 2,5-5 mg i saltvand i 5-15 minutter, ikke mere end 4 gange om dagen; inde 8-16 mg pr. dag; intramuskulært ved 500 mcg med et interval på 4 timer; IV bolus på 250 mcg efterfulgt af en infusion på 5-20 mcg/min.
Fenoterol
En anelse overlegen i forhold til salbutamol i aktivitet og virkningsvarighed. Det har 10 gange lavere selektivitet, hvilket bestemmer den hyppigere udvikling af bivirkninger og værre tolerance. Farmakokinetik er tæt på salbutamol.
Dosering:
voksne indånding 100-200 mcg (1 åndedræt) ikke mere end 3-4 gange om dagen; ved hjælp af en spinhaler i pulver, 200-400 mcg ikke mere end 4 gange om dagen;
METHYLXANTINER
Methylxanthiner omfatter det naturlige alkaloid theophyllin og dets semisyntetiske derivater, som har været brugt i bronkial astma i 50 år.
Theophyllin
Ønsket om at udskyde udnævnelsen af theophyllin til et senere tidspunkt forklares af dets mangler - behovet for gentagen oral administration, skarpe udsving i blodkoncentrationen og en lille bredde af terapeutisk virkning, som bestemmer den høje risiko for bivirkninger.
Der anvendes i øjeblikket to doseringsformer af theophyllin: hurtigtvirkende, men korttidsvirkende præparater, som er ønskelige til at blive brugt som ekstra bronkodilatatorer, når b2-agonister er ineffektive, og præparater med forlænget frigivelse af det aktive stof, som bruges til at forhindre natlig angreb.
Virkningsmekanisme.
Det består af flere elementer: hæmning af phosphodiesterase, hvilket fører til en stigning i koncentrationen af cAMP i myofibriller; konkurrerende med adenosininteraktion med purinreceptorer; intracellulær omfordeling af calciumioner på grund af øget optagelse af mitokondrier og et fald i dets indhold i cytoplasmaet; undertrykkelse af prostaglandinsyntese; nedsat frigivelse af histamin fra mastceller; øget følsomhed af b2-adrenerge receptorer; hæmning af enzymet 5-nukleotidase. Derudover har theophyllin en metabolisk effekt, hvilket forårsager øget produktion af adrenalin, noradrenalin, insulin, frie fedtsyrer.
Plads i terapi
Korttidsvirkende theophyllinpræparater kan bruges til at forebygge astmaanfald på 3. og 4. stadie i fravær af længerevarende theophyllinpræparater, samt til at lindre astmasymptomer på alle stadier af behandlingen i mangel af virkning af sympatomimetika og M-cholinolytika. .
stoffer
Aminofyllin
(eufillin) - et semisyntetisk lægemiddel, som er en forbindelse af 80% theophyllin med 20% 1,2-ethylendiamin, opløselig i vand.
Dosering: se Theophyllin doseringsalgoritme.
Frigivelsesformularer: tabletter på 0,15 g; 10 ml ampuller med 2,4 % og 1 ml 24 % opløsning.
Langtidsvirkende theophyllinpræparater er beskrevet ovenfor i afsnittet "Lægemidler, der styrer forløbet af bronkial astma."
VURDERING AF ASTHMAKONTROL OG PIKSFLOWMETRIK
Behandling af patienter med astma udføres i lang tid, næsten for livet. Moderne medicin bidrager til opnåelse af kontrol over sygdommen, forhindrer dens komplikationer, opretholder effektiviteten og påvirker de medicinske indikatorer for livskvalitet positivt. Uanset sværhedsgraden af sygdommen er det nødvendigt at stræbe efter fuldstændig kontrol af astma. De anvendte farmakoterapeutiske regimer varierer afhængigt af de kliniske manifestationer af sygdommen og resultaterne af monitorering af peak forceret ekspiratorisk flow (PEF). PSV-værdien korrelerer tæt med FEV1-værdien og er et pålideligt værktøj til overvågning af bronkial åbenhed derhjemme.
Måling af PSV udføres 2 gange om dagen: om morgenen - umiddelbart efter opvågning og om aftenen - før sengetid, før du tager anti-astmatiske lægemidler. Før undersøgelsen skal patienten instrueres omhyggeligt (vægt på fuldstændigheden af indånding og udånding, maksimal indsats ved udførelse af en tvungen manøvre, forebyggelse af luftlækage), og proceduren demonstreres. Manøvren skal udføres stående i tre forsøg. Den maksimale værdi indtastes i selvkontroldagbogen. Ved afslutningen af observationsperioden (uge, måned osv.) foretages de nødvendige beregninger for at vurdere patientens tilstand og effektiviteten af behandlingen, hvorefter der besluttes at opretholde (nedsætte, øge) det anvendte farmakoterapeutiske regime. .
Litteratur.
- Astma og allergi: en håndbog, red. A.Yu.Bolotina.-M..2000
- Bronkial astma: en guide til læger / Redigeret af A.A. Punin, A.I. Borokhov, R.S. Bogacheva.-Smolensk, 2003
- Chuchalin A.G. Bronchial asthma.-M, .1985
4.Chuchalin A.G. Det russiske nationale astmakontrolprogram, Materia Medico. Bulletin for læger og farmaceuter, 1998, N2, bind 18, s. 3-7.
5. Avdeev SN, Chuchalin AG. Sympatomimetika ved alvorlig forværring af bronkial astma. RMJ 2000; 8(4):166-173.
6. Alekseev VG, Yakovlev VN. Bronkial astma. Essays om klinisk pulmonologi. M, 1998: 87-143.
7. Bronkial astma. Global strategi. Pulmonology, 1996. Bilag 166 cc.
8. Fedoseev GB. Bronkial astma. Praktiserende læges bibliotek. St. Petersborg, Med informationsbureau, 1996. Vol. 2. 464 cc.
9. Chuchalin AG. Bronkial astma. M: Agar, 1997. T.I og II. 432, 400 s.
10. G. B. Fedoseev, G. P. Khlopotova. "Bronkial astma." - M .: Medicin, 1988
11. G. B. Fedoseev "Bronkial astma." Medical Information Agency, St. Petersborg, 1996
12. Agertoft L., Pedersen S. Effekt af langtidsbehandling med inhaleret budesonid på voksenhøjde hos børn med astma. N Engl J Med 2000; 343:1064-9
13. Ankerst J., Persson G., Weibull E. En høj dosis budesonid/formoterol i en enkelt inhalator blev godt tolereret af astmatiske patienter. Eur Respir J 2000; 16 (Suppl 31): 33s+plakat .
986 0
Behandling af syge bronkial astma (BA) er kompleks, omfatter den lægemiddel- og ikke-lægemiddelbehandling i overensstemmelse med det antiallergiske regime.
To typer lægemidler anvendes til medicinsk behandling af sygdommen: lægemidler til akutbehandling og forebyggende lægemidler til langsigtet kontrol af astma.
Akut medicin
i 2-korttidsvirkende agonister - salbutamol, fenoterol, terbutalin - forårsager afslapning af de glatte muskler i bronkierne, øget mucociliær clearance og et fald i vaskulær permeabilitet. Den foretrukne indgivelsesvej for disse lægemidler er ved inhalation. For at gøre dette er 2-agonister tilgængelige i form af aerosoler med afmålt dosis, pulverinhalatorer og opløsninger til forstøver. Hvis det er nødvendigt at administrere store doser, anvendes inhalationer af salbutamol eller fenoterol gennem en forstøver.Anticholinergika (ipratropiumbromid) er mindre potente bronkodilatatorer end 2-agonister og har tendens til at tage længere tid at virke. Det skal bemærkes, at ipratropiumbromid øger virkningen af 2-agonister, når de bruges sammen (fast kombination med fenoterol - berodual). Administrationsmetoden er inhalation.
Systemisk glukokortikosteroider (GKS)(prednisolon, methylprednisolon, triamcinolon, dexamethason, betamethason). Indgivelsesvejen er parenteral eller oral. Præference gives til oral terapi.
Korttidsvirkende theofylliner er bronkodilatatorer, der generelt er mindre effektive end inhalerede theofylliner. in-adrenerge stimulanser (annoncer). Theophyllin har betydelige bivirkninger, som kan undgås ved korrekt dosering af lægemidlet og overvågning af dets plasmakoncentrationer. Hvis patienten får slow-release theophyllin-præparater, er bestemmelse af theophyllin-plasmakoncentrationen før administrationen obligatorisk.
Profylaktiske lægemidler til langsigtet kontrol af bronkial astma
Inhalerede kortikosteroider (beclomethasondipropionat, budesonid, flunisolid, fluticasonpropionat, triamcinolonacetonid). De bruges som antiinflammatoriske lægemidler til at kontrollere forløbet af bronkial astma i lang tid. Doser bestemmes af sværhedsgraden af astma. Behandling med inhalerede kortikosteroider ordineres gennem en spacer, som bidrager til mere effektiv kontrol af astma og reducerer nogle bivirkninger.Cromoner (natriumkromoglycat og nedocromil) er ikke-steroide inhalationsanti-inflammatoriske lægemidler til langsigtet kontrol af bronkial astma. Effektiv til at forhindre bronkospasmer udløst af allergener, træning og kold luft.
B 2 -langtidsvirkende agonister (salmeterol, formoterol, saltos). Specielt effektiv til at forhindre natlige kvælningsanfald. Anvendes i kombination med antiinflammatoriske basislægemidler. Anvendelsesmetoder - oral eller inhalation.
Langtidsvirkende theofylliner
Påføringsmetoden er mundtlig. På grund af den langvarige handling falder hyppigheden af natteangreb, de tidlige og sene faser af den allergiske reaktion bremses. Det er nødvendigt at overvåge indholdet af theophyllin i plasma for at undgå overdosering med alvorlige komplikationer.Leukotrien-receptorantagonister (zafirlukast, montelukast) er en ny gruppe af anti-inflammatoriske anti-astma-lægemidler. Anvendelsesmetode - mundtlig. Narkotika forbedres åndedrætsfunktion (FVD), reducere behovet for korttidsvirkende 2-agonister, er effektive til at forhindre bronkospasme fremkaldt af allergener, fysisk aktivitet.
Systemiske kortikosteroider anvendes ved svær astma. De skal gives med den laveste daglige dosis eller om muligt tages hver anden dag.
Kombinerede lægemidler
På trods af det faktum, at inhalerede kortikosteroider er grundpillen i astmaterapi, tillader de ikke altid fuldstændig kontrol over den inflammatoriske proces i bronkialtræet og følgelig manifestationerne af bronkial astma. I denne forbindelse var der behov for at tilføje langtidsvirkende AdS til inhaleret GCS.På det farmaceutiske marked er de repræsenteret af to lægemidler: formoterol og salmeterol. Tilsætning af langtidsvirkende 2-agonister anbefales ved utilstrækkelig kontrol af BA ved monoterapi med inhalerede kortikosteroider (startende fra trin 2). En række undersøgelser har vist, at kombinationen af inhalerede kortikosteroider med langtidsvirkende β 2 -agonister er mere effektiv end en fordobling af dosis af inhalerede kortikosteroider, og fører til bedre kontrol af astmasymptomer og en mere signifikant forbedring af lungefunktionen.
Det har også vist sig at reducere antallet af eksacerbationer og forbedre livskvaliteten hos patienter, der får kombinationsbehandling. Således var skabelsen af kombinerede lægemidler, hvis bestanddele er inhalerede kortikosteroider og langtidsvirkende β 2 -agonister, resultatet af udviklingen af synspunkter om behandling af bronkial astma.
Som nævnt ovenfor anvendes Seretide og Symbicort i øjeblikket som kombinationslægemidler.
Trinvis tilgang til terapi
Ved behandling af astma anvendes i dag en trinvis tilgang, hvor intensiteten af terapien øges i takt med, at sværhedsgraden af astma stiger (den mindste sværhedsgrad svarer til trin 1, og den største sværhedsgrad til trin 4). Skemaer for trinvis behandling af bronkial astma hos voksne er vist i tabel 5.| Alvorlighed |
Grundlæggende forberedelser terapi |
Andre muligheder terapi |
| Scene 1 Intermitterende astma |
kursus behandling er ikke påkrævet |
|
| Etape 2 Lys vedvarende astma |
inhalerede glukokortikosteroider (IGCS)( | langsom frigivelse af theofylliner eller Cromons eller Leukotrien-antagonister |
| Trin 3 Vedvarende moderat astma |
ICS (200-1000 mikrogram beclomethasondipropionat eller tilsvarende doser af andre ICS) + langtidsvirkende inhalerede 2-agonister | ICS (500-1000 mcg beclomethasondipropionat eller tilsvarende doser af andre ICS'er) + slow-release theofylliner eller ICS (500-1000 mcg beclomethasondipropionat eller tilsvarende doser af andre ICS) + langtidsvirkende orale β2-agonister eller Højere dosis ICS (>1000 mcg beclomethasondipropionat eller tilsvarende doser af andre ICS) eller ICS (500-1000 mcg beclomethasondipropionat eller tilsvarende doser af andre ICS'er) + leukotrienantagonister |
| Trin 4 tung vedvarende astma |
ICS (>1000 mcg beclomethasondipropionat eller tilsvarende doser af andre ICS'er) + inhalerede langtidsvirkende 2-agonister + om nødvendigt en eller flere af følgende: - langsom frigivelse af theofylliner - leukotrienantagonister - oral i 2 -langtidsvirkende agonister - orale glukokortikoider |
Bemærk: På et hvilket som helst tidspunkt, hvis astmakontrol opnås og opretholdes i mindst 3 måneder, bør man forsøge at nedtrappe vedligeholdelsesbehandlingen for at bestemme den minimumsmængde af terapi, der er nødvendig for at kontrollere sygdommen. På ethvert stadium, ud over grundlæggende terapi, er inhalationsmedicin ordineret. 2 - korttidsvirkende agonister efter behov for at lindre symptomer, dog ikke mere end 3-4 gange dagligt.
Målet med trinvis terapi er at opnå astmakontrol med den mindste mængde medicin. Mængden, hyppigheden og doseringen af medicin stiger (trin op), hvis astma forværres og falder (trappe ned), hvis astma er godt kontrolleret. På hvert trin skal eksponering for triggerfaktorer undgås eller kontrolleres.
Fase 1. Intermitterende (episodisk) forløb af BA. Langtidsbehandling med antiinflammatoriske lægemidler er normalt ikke indiceret.
Behandling omfatter profylaktisk medicin før træning, eksponering for et allergen eller anden udløsende faktor (inhalerede β2-agonister, cromoglycat eller nedocromil). Anticholinergika, orale korttidsvirkende β2-agonister eller korttidsvirkende theofylliner kan tilbydes som alternativer til inhalerede korttidsvirkende β2-agonister, selvom disse lægemidler har en forsinket indtræden af virkning og/eller en højere risiko for bivirkninger.
Stadium 2. Mildt vedvarende forløb af bronkial astma. Patienter med mild vedvarende astma har brug for daglig langtidsprofylaktisk medicin: inhalerede kortikosteroider 200-500 mcg/dag eller natriumkromoglycat eller nedocromil i standarddoser.
Hvis symptomerne fortsætter på trods af den indledende dosis af inhalerede kortikosteroider, og lægen er sikker på, at patienten bruger stofferne korrekt, bør dosis af inhalerede glukokortikosteroider øges fra 400-500 til 750-800 mcg/dag af beclomethasondipropionat eller tilsvarende dosis af et andet inhaleret kortikosteroid. Et muligt alternativ til at øge dosis af inhalerede kortikosteroider, især for at kontrollere natlige symptomer, er at tilføje til dosis af inhalerede kortikosteroider ikke mindre end 50 mcg langtidsvirkende 2-agonister (formoterol, salmeterol) om natten.
Hvis astmakontrol ikke kan opnås, hvilket kommer til udtryk ved hyppigere symptomer, en stigning i behovet for korttidsvirkende bronkodilatatorer eller et fald i PEF, så fortsæt til trin 3.
Trin 3. Moderat kursus BA. Patienter med moderat astma kræver daglig indtagelse af profylaktiske antiinflammatoriske lægemidler for at etablere og opretholde kontrol over bronkial astma. Dosis af inhalerede kortikosteroider bør være på niveauet 800-2000 mcg beclomethasondipropionat eller en tilsvarende dosis af et andet inhaleret kortikosteroid.
Langtidsvirkende bronkodilatatorer kan også ordineres ud over inhalerede kortikosteroider, især for at kontrollere natlige symptomer (teofylliner og langtidsvirkende 2-agonister kan anvendes). Symptomer bør behandles med korttidsvirkende 2-agonister eller alternative lægemidler. Ved mere alvorlige eksacerbationer bør der udføres et behandlingsforløb med orale kortikosteroider.
Hvis astmakontrol ikke opnås, hvilket kommer til udtryk ved hyppigere symptomer, øget behov for bronkodilatatorer eller fald maksimal ekspiratorisk flow (PSV), og gå derefter til trin 4.
Trin 4. Alvorlig BA. Hos patienter med svær bronkial astma kan astma ikke kontrolleres fuldstændigt. Målet med behandlingen er at opnå de bedst mulige resultater: det mindste antal symptomer, det mindste behov for korttidsvirkende 2-agonister, de bedst mulige PEF-værdier, den minimale variation i PEF og de minimale bivirkninger fra lægemidler. Behandling er normalt med et stort antal astma-kontrollerende lægemidler.
Primær behandling omfatter inhalerede kortikosteroider i høje doser (800-2000 mcg/dag af beclomethasondipropionat eller tilsvarende doser af andre inhalerede kortikosteroider). Langtidsvirkende bronkodilatatorer anbefales at tilføje til inhalerede kortikosteroider. Et antikolinergt lægemiddel (ipratropiumbromid) kan anvendes, især hos patienter, der rapporterer bivirkninger fra β 2 -agonister.
Korttidsvirkende inhalerede β 2 -agonister kan om nødvendigt anvendes til at lindre symptomer, men hyppigheden af deres brug bør ikke overstige 3-4 gange dagligt. En mere alvorlig eksacerbation kan kræve en behandling med orale kortikosteroider.
Metoder til optimering af anti-astmabehandling
Metoder til optimering af anti-astmabehandling kan beskrives i form af blokke som følger.Blok 1. Det første besøg af patienten til lægen, vurdering af sværhedsgraden, bestemmelse af taktikken til at styre patienten. Hvis patientens tilstand kræver akut behandling, er det bedre at indlægge ham på hospitalet. Ved det første besøg er det vanskeligt nøjagtigt at bestemme sværhedsgraden, da dette kræver at kende udsvingene i PEF og sværhedsgraden af kliniske symptomer i løbet af ugen. Sørg for at tage højde for mængden af terapi før det første besøg hos lægen. Den allerede ordinerede behandling bør fortsættes i overvågningsperioden. Om nødvendigt kan yderligere korttidsvirkende annoncer anbefales.
Hvis en patient med formodentlig mild eller moderat astma ikke har behov for fuld nødbehandling, ordineres en indledende ugentlig overvågningsperiode. Ellers er det nødvendigt at udføre passende behandling og overvåge patienten i 2 uger. Patienten udfylder en dagbog over kliniske symptomer og registrerer PSV-værdier i aften- og morgentimerne.
Blok 2. Bestemmelse af sværhedsgraden af astma og valg af passende behandling udføres på grundlag af klassificeringen af bronkial astma efter sværhedsgrad. Et besøg til lægen er forudset en uge efter det første besøg, hvis behandlingen ikke er ordineret fuldt ud.
Blok 3. En to-ugers monitoreringsperiode på baggrund af igangværende terapi. Patienten udfylder en dagbog over kliniske symptomer og registrerer PSV-værdier.
Blok 4. Evaluering af terapiens effektivitet. Besøg efter 2 uger på baggrund af igangværende terapi.
Blive bedre. Behandlingsvolumen bør øges, hvis astmakontrol ikke kan opnås. Det bør dog vurderes, om patienten tager medicin af passende niveau korrekt, og om der er kontakt med allergener eller andre provokerende faktorer.
Kontrol af bronkial astma anses for utilfredsstillende, hvis patienten:
Episoder med hoste, hvæsende vejrtrækning eller vejrtrækningsbesvær forekommer mere end 3 gange om ugen;
- symptomer opstår om natten eller i de tidlige morgentimer;
- øget behov for brug af korttidsvirkende bronkodilatatorer;
- Spredningen af PSV-indikatorer øges.
Træde ned. En reduktion af vedligeholdelsesbehandlingen er mulig, hvis astmaen forbliver under kontrol i mindst 3 måneder. Dette er med til at mindske risikoen for bivirkninger og øger patientens modtagelighed for den planlagte behandling. Reducer terapien skal være trinvist, gradvist at sænke dosis eller annullere yderligere lægemidler. Det er nødvendigt at overvåge symptomer, kliniske manifestationer og indikatorer for respiratorisk funktion.
Selvom AD er en uhelbredelig sygdom, er det således rimeligt at forvente, at størstedelen af patienterne kan og bør opnå kontrol over sygdomsforløbet.
Det er også vigtigt at bemærke, at tilgangen til diagnosticering, klassificering og behandling af bronkial astma, under hensyntagen til sværhedsgraden af dens forløb, giver dig mulighed for at oprette fleksible behandlingsplaner og særlige behandlingsprogrammer afhængigt af tilgængeligheden af anti-astmamedicin, det regionale sundhedsvæsen og karakteristika for en bestemt patient.
Det skal endnu en gang mindes om, at et af de centrale steder i behandlingen af astma i øjeblikket er optaget af et uddannelsesprogram for patienter og ambulatorieobservation.
Saperov V.N., Andreeva I.I., Musalimova G.G.


