29.06.2020
Адреномиметики. Классификация
а) неизбирательного действия (неселективные): изопреналин
б) избирательного действия («селективные»):
· b 1 - адреномиметик : добутамин;
· b 2 - адреномиметики :
- средней продолжительности действия : сальбутамол, фенотерол,
- продленного действия : сальметерол, формотерол.
Изопреналин (изадрин). Синтетический катехоламин - изопропилнорадреналин. Неселективный β 1 ,β 2 -адреномиметик .
Прямо возбуждает в равной степени бета 2 -рецепторы бронхов ═> бронхолитический эффект, улучшение мукоцилиарного транспорта; и бета1-рецепторы сердца ═> мощное кардиотоническое действие: все 4 функции сердца (автоматизм, проводимость, возбудимость, сократимость ═> ЧСС, УО и МО, A-V проводимости).
Показания к применению:
1) При брадиаритмиях с нарушением A-V проводимости - сублингвально.
2) Как бронхолитик а) для купирования бронхоспазма в виде ингаляций: По 1-2 мл в ингалятор для последующего вдыхания при бронхоспазме; б) для предупреждения бронхоспазма – таблетки.
Побочные эффекты многочисленны и связаны с неселективностью. При бронхиальной астме сейчас практически не используют , т.к. 1) вызывает тахикардию, тахиаритмию (в т.ч.экстрасистолию), возможно усиление стенокардитических болей, т.к. потребность миокарда в кислороде, 2) вызывает изъязвление слизистой рта при приеме под язык, 3) оказывает влияние на ЦНС - головная боль, тремор конечностей.
Сальбутамол – «селективный» бета 2 -адреномиметик - в виде дозированного аэрозоля используется как бронхолитик для купирования приступов бронхиальной астмы.
В терапевтических дозах не вызывает тахикардии. Основное показание – купирование бронхоспазма, иногда – предупреждение (перед выходом на мороз)
В акушерстве под названием «сальбупарт» используется как токолитик (расслабляет матку).
Фенотерол– «селективный» бета 2 -адреномиметик – действует длительнее, чем сальбутамол – до 5-6 часов, поэтому может использоватьсяи для купирования идля профилактики приступов бронхоспазма. Входит в состав комбинированных препаратов: «Беродуал» (фенотерол+ипратропия бромид); «Дитек» (фенотерол+кромолин натрий).
Под названием «Партусистен» используется в акушерстве как токолитик (при угрозе преждевременных родов).
Селективность бета 2 -адреномиметик относительна . При передозировке развиваются побочные эффекты, связанные с возбуждением бета1-адренорецепторов: тахиакардия, тахиаритмия, потребления миокардом кислорода => усиление стенокардитических болей, возбуждение ЦНС (тремор конечностей, бессонница и пр.).
Добутамин (добутрекс) - «селективный» бета1-адреномиметик. Синтетический катехоламин, близкий по химической структуре к дофамину.
Избирательно и прямо стимулирует бета1-адренорецепторы, оказывая выраженное инотропное действие ( силу сердечного сокращения) В связи с инотропным эффектом повышается коронарный кровоток.. На дофаминовые рецепторы не влияет, сосуды почек не расширяет, но в связи с усилением сердечного выброса улучшает перфузию почек и усиливает диурез у больны с сердечной недостаточностью. Вводится в/в, капельно (в 5% р-ре глюкозы).
Показания – острая сердечная недостаточность, декомпенсация сердечной деятельности при хронической сердечной недостаточности.
b-адреномиметики
Родоначальником этой группы препаратов стал изадрин(изопропилнорадреналин). За счет стимуляции b1-рецепторов сердца, препарат вызывает увеличение силы и частоты сердечных сокращений, повышает проводимость. Увеличивается и потребность миокарда в кислороде. При этом общее периферическое сопротивление сосудов, как и почечный кровоток, уменьшается. Это ведет к небольшому снижению АД. За счет влияния на b2-рецепторы препарат оказывает бронхорасширяющее действие. Кроме того, он уменьшает отек слизистой бронхиального дерева, уменьшает выделение гистамина тучными клетками. Применяется препарат при лечении бронхиальной астмы, брадиаритмий.
Более селективным препаратом является орципреналина сульфат (алупент), который действует преимущественно на b2-адренорецепторы. Препарат в меньшей степени вызывает тахикардию. Применяется он для лечения бронхиальной астмы.
b1-адреномиметики- препараты, оказывающие влияние только на миокард, что используется в случаях, когда сердечную деятельность надо активизировать. Применяют их внутривенно при острой сердечной недостаточности.
b2-Адреномиметики - основная группа препаратов, используемых для купирования приступа бронхиальной астмы и других болезней, характеризующихся спазмом бронхов. В настоящее время синтезировано большое количество таких препаратов, ими широко пользуются пациенты во всем мире. Как правило, эти препараты имеют форму дозированных аэрозолей. При ингаляционном применении препаратыначинают действовать очень быстро. Через несколько минут бронхи расширяются; при этом препарат очень мало всасывается в кровь с поверхности слизистой бронхов и практически не влияет на b-рецепторы в других органах и тканях. Селективные b-адреномиметики гораздо реже вызывают побочные эффекты со стороны сердца.
Современные бронхорасширяющие b2-адреномиметики (бронходилататоры, бронхолитики) делятсяпрепараты короткого действия (ингаляционные формы - сальбутамол, фенотерол, тербуталин), b2-адреномиметики длительного действия (ингаляционные формы - салметерол, формотерол; пероральные формы сальбутамола замедленного высвобождения - вольмакс, сальтос и др.)
В отличие от изадрина, препараты данной группы не разрушаются КОМТ и путем экстранейронального захвата, поэтому способны действовать более длительно.
b2-адреномиметикикороткого действия обычно используются для купирования приступа бронхиальной астмы. Начало и продолжительность их действия зависит от способа введения. Длительное применение 10 и более ингаляционных доз в сутки b2-агонистов короткого действия может привести к передозировке: сердцебиению, тошноте, а также снижению их эффективности, выраженному усугублению приступов удушья (синдром замыкания легких).
b2-адреномиметики длительного действия характеризуются медленным началом действия. Медленное развитие эффекта, сочетающееся с его длительностью, означает, что эти препараты не являются средствами неотложной помощи. Их ценность заключается в том, что они способны обеспечить продолжительный период (около 12 ч) защиты от бронхоспазма. Поэтому они используются в качестве профилактической (базисной) терапии астмы и позволяют уменьшить потребность в бронхолитиках короткого действия.
Все b-адреномиметики снижают тонус и сократимость миометрия и могут быть эффективны при невынашивании беременности (партусистен).
Побочные эффекты при применении β 1 -aдреномиметиков - отмечают тахикардию, повышение потребления миокардом кислорода вследствие увеличения работы сердца, загрудинные боли, аритмии.
Побочные эффекты при применении β 2 -aдреномиметиков связаны в основном со стимуляцией β 2 -aдренорецепторов:
Расширение периферических сосудов и снижение диастолического давления;
Тахикардия, которая рефлекторно возникает в ответ на снижение артериального давления, а также связана с прямым возбуждением β 2 -aдренорецепторов сердца, плотность которых в предсердиях составляет более 25% (некоторое значение имеет также частичная стимуляция β 1 -aдренорецепторов);
Тремор (вследствие стимуляции β 2 -aдренорецепторов скелетных мышц).
Отмечают также беспокойство, повышенную потливость, головокружение.
Побочные эффекты β 1,2 -aдреномиметиков: вызывает более выраженную тахикардию, в большей степени повышает потребность миокарда в кислороде, высока опасность возникновения аритмий
4. Β2-адреномиметики
Составляют основу лечения БА, в частности, купирования приступа. Стимуляруя В 2 -адренорецепторы снижают внутриклеточную концентрацию Са ++ , расслабляют гладкую мускулатуру бронхиального дерева. Усиливают функцию мерцательного эпителия. Увеличивают просвет бронхов на 150-200% (сильнее, чем остальные бронхолитики). Расширяют преимущественно бронхи среднего и мелкого калибра. Используются, главным образом, ингаляционно.
ПЭ: Тремор, тахикардия (чаще фенотерол), снижение эффекта – при бесконтрольном применении за счет снижения чувствительности рецепторов, отечности слизистых. Бесконтрольное применение может привести к статусу.
5. М-холиноблокаторы - применяются при БА (у пожилых пациентов, при гиперсекреции бронхиальных желез, преимущественно ночных приступах, более эффективны при ХОБЛ). Блокируют селективно М-холинорецепторы бронхиального дерева, расширяют премущественно крупные бронхи, по бронхолитическому эффекту – слабее В 2 -адреномиметиков, менее токсичны. При длительном применении – эффективность не снижается.
Ипратропия бромид (Атровент) – основной препарат данной группы. Бронхолитический эффект развивается позднее, чем у В 2 -адреномиметиков, через 20-30 мин. Входит в состав комбинированного препарата – Беродуал (с фенотеролом)
Ипратропия йодид (Тровентол) – используется ограниченно
Тиотропия бромид (спирива) – пролонгированный эффект, назначается 1 раз в сутки, используется в качестве базисной терапии при ХОБЛ.
6.Препараты теофиллина
Блокируют фосфодиэстеразу, снижают внутриклеточную концентрацию Са++, оказывают бронхорасширяющий эффект. Блокируя аденозиновые рецепторы препараты стабилизируют мембраны тучных клеток, улучшают мукоцилиарный клиренс, стимулируют дыхательный центр. Уменьшают давление в малом круге кровообращения, снижая, таким образом, риск развития отека легких при тяжелом приступе бронхиальной астмы.
Относятся группе токсичных препаратов: тахикардия, гипотония, возбуждение, тремор рук, может быть судорожный синдром. При приеме внутрь могут раздражать слизистую желудка.
Муколитические и отхаркивающие средства:
1. Усиливающие мукоцилиарный клиренс .
А) Рефлекторного действия (мукалтин, термопсис, алтей, солодка, истод, подорожник, мать-и-мачеха) – у детей раннего возраста необходимо применять с осторожностью, т.к. избыточная стимуляция рвотного и кашлевого центров может привести к аспирации, особенно если ребенок имеет патологию ЦНС.
Б) Резорбтивного действия (минеральные воды, йодид калия, натрия гидрокарбонат, терпингидрат) – в настоящее время используются реже.
В) В-адреномиметики, ксантины, ГКС
2. Секретолитики (химотрипсин, ацетилцистеин, Н-ацетилцистеин, карбоцистеин) – применяются редко, т.к. высокоаллергогенны
3. Стимуляторы выработки сурфактанта (бромгексин, амброксол) – обладают дополнительным отхаркивающим эффектом, наиболее употребляемые муколитические средства.
Алгоритм выбора препаратов, влияющих на кашель:
1. Муколитические препараты показаны при продуктивном кашле с густой, вязкой, трудноотделяемой мокротой. Препараты нельзя сочетать с противокашлевыми средствами (кодеин, глауцин, преноксиндиазин и др.)
2. Отхаркивающие средства показаны, когда кашель не сопровождается наличием густой, вязкой, трудноотделяемой мокротой.
Ступенчатый подход к медикаментозной терапии БА
Заключается в том, что:
Терапию начинают со ступени, соответствующей тяжести заболевания;
Впоследствии интенсивность терапии (выбор ЛС, дозу и частоту введения) меняют в зависимости от изменения тяжести состояния.
1 ступень – Легкое интермитирующее течение
2 ступень – Легкое персистирующее течение
3 ступень – Среднетяжелое течение БА
4 ступень – Тяжелое течение БА
Схему лечения необходимо пересматривать каждые 3 – 6 месяцев:
Ступень вниз: если контролирование симптомов поддерживается в течение последних 3 месяцев, то возможно постепенное уменьшение медикаментозного лечения.
Ступень вверх: если контролирование симптомов астмы недостаточное, то рекомендуется перейти на более высокую ступень, но сначала проверьте, правильно ли больной пользуется лекарственными средствами, следует ли он советам, условия его жизни.
Астматический статус.
Основные принципы лечения:
1. Кортикостероиды (оказывают противовоспалительное, противоотечное действие, восстанавливают чувствительность В 2 -адренорецепторов, устраняют угрозу надпочечниковой недостаточности, которая может развиться на гипоксию, усиливают бронходилятирующий эффект эндогенных катехоламинов). Введение кортикостероидов проводят до выведения пациента из статуса.
Стартовая доза преднизолона составляет до 8 мг/кг в виде болюса, затем каждые 3 – 6 часов по 2 мг/кг до клинического улучшения, далее постепенное снижение дозы (на 25-30% в сутки) до минимальной поддерживающей дозы.
Терапия СГКС внутрь проводится из расчета 0,5 мг/кг по преднизолону.
2. Метилксантины – эуфиллин в/в (оказывает бронходилятирующий эффект, снижает давление в малом круге кровообращения, уменьшает агрегацию тромбоцитов)
Начальная доза – 5 – 6 мг/кг в/в медленно (за 15 – 20 минут), затем в/в капельно со скоростью 0,7 – 1,0 мк/кг/час до улучшения состояния.
3. В 2 - агонисты короткого действия (предпочтительнее сальбутамол или беродуал) вводятся ингаляционно с помощью небулайзера 3 – 4 раза в сутки.
4. Инфузионная терапия - восполняет дефицит ОЦК, улучшает микроциркуляцию увеличивает водный компонент мокроты). Все вводимые растворы гепаринизируются (2,5 тыс. Ед. гепарина на 500 мл жидкости).
Инфузионная терапия проводится в объеме 30 – 50 мл/кг под контролем ЦВД, которое не должно превышать 120 мм.вод.ст., диуреза – не менее, 80 мл/час.
5. Оксигенотерапия предупреждает неблагоприятные воздействия гипоксемии на процессы тканевого метаболизма. Проводятся ингаляции увлажненного кислорода через носовые катетеры со скоростью 2 – 6 л/мин.
6. Улучшение отхождения мокроты : введение ингаляционно через небулайзер или в/в амброксола, 10% калия йодида, вибрационный массаж грудной клетки. Во 2-ую стадию проводится неотложная лечебная бронхоскопия
7. Коррекция ацидоза : введение гидрокарбоната натрия под контролем КЩС.
8. Симптоматическая терапия .
Бета-2-агонисты — старейшие и наиболее широко используемые препараты для лечения бронхиальной астмы. Нет ни одного крупного обобщения, за последние 20 лет, где бы не отмечалось, что ингаляционные бета-агонисты являются средством выбора при терапии обострений бронхиальной астмы. При объяснении механизма воздействий бета-агонистов внимание фокусируется в основном на бета-2-адренергическом рецепторе дыхательных путей, который принципиально отвечает за бронхорасширяющий эффект.
Классификация адренергических рецепторов основана на патофизиологических эффектах различных агонистов, результатах исследования активности и связывания агонистов и антагонистов этими рецепторами и последующего определения их строения (последовательности аминокислот).
Структура и функция бета-2-адренергических рецепторов. Адренергические рецепторы являются членами большой суперсемьи G-белок-связанных рецепторов и их функционирование осуществляется посредством аденилатциклазной системы. Бета-2-адренергический рецептор содержит семь гидрофобных трансмембранных участков. Его функция зависит от связывания с Gs-белком, который стимулируется аденилатциклазой, ведущей к увеличению уровня цАМФ в клетке, действующей как вторичный мессенджер и вызывающий активацию функции рецептора. По крайней мере, отчасти действие бета-2-адренергического рецептора на гладкую мышцу заключается в открытии кальцием-активируемых калиевых каналов, через цАМФ или прямо через Gs-белок. Повышенные концентрации цАМФ, кроме расслабления гладких мышц бронхов, ингибируют высвобождение медиаторов реакции гиперчувствительности немедленного типа, особенно из тучных клеток .
После связывания рецептора или передачи сигнала отмечается снижение чувствительности бета-2-адренергического рецептора к дальнейшей стимуляции. Этот процесс десенситизации имеет две фазы. Первая, продолжительностью от нескольких секунд до минут, характеризуется отщеплением бета-2-адренергического рецептора от Gs-белка путем фосфорилирования цитоплазматических участков. В этом случае происходит быстрое отщепление рецептора и быстрое восстановление связи при удалении активирующего стимула. Вторая фаза десенситизации связывается с длительной экспозицией агониста в течение нескольких часов и проявляется снижением аффинности рецептора к агонисту, либо нарушением связи рецептора с аденилатцик-лазной системой. Этот процесс может быть связан с механизмами, независимыми от цАМФ, или вызываться цАМФ через снижение транскрипции м-РНК для бета-2-адренергического рецептора. Существуют также механизмы, вызывающие новый синтез рецепторов через цАМФ, модулирующую экспрессию бета-2-адренергического рецептора .
Распределение бета-2-адренергических рецепторов. Бета-2-адренергические рецепторы широко представлены в дыхательных путях и присутствуют на гладкомышечных клетках, эпителии, в подслизистых железах, альвеолах, пресинаптических нервах, также как на многочисленных воспалительных клетках, участвующих в астматическом процессе . Хотя иннервации гладкой мускулатуры адренергическими нервами у человека нет, бета-2-адренергические рецепторы представлены здесь обильно. Напротив, легочные сосуды богаты симпатической иннервацией. Принципиальное действие бета-2-агонистов состоит в стимуляции соответствующих рецепторов гладкой мускулатуры, ведущей к бронходилятации. Максимальная плотность бета-адренорецепторов определяется на уровне мелких и средних бронхов. Хотя бета-2-агонисты могуттакже увеличивать мукоцилиарный клиренс, секрецию слизистых желез, продукцию сурфактанта, и модулировать холинергическую нейротрансмиссию, эти эффекты минимальны по сравнению с их действием на гладкую мускулатуру .
Классификация симпатомиметиков и их фармакологическое воздействие. R.P.Ahlquist (1948) впервые классифицировал два типа: адренорецепторов: альфа-рецепторы, с наивысшей аффинностью к адреналину, и бета-рецепторы, характеризующиеся высокой аффинностью к изопротеренолу. Стимуляция альфа-рецепторов вызывает спазм гладкой мускулатуры, тогда как стимуляция бета-рецептора — ее релаксацию. А.М.Lands и соавт. (1967) в дальнейшем дифференцировали бета-агонисты на бета-1 и бета-2 подтипы. Бета-1 рецептор имеет равную аффинность к адреналину и норадреналину, бета-2 — большую аффинность к адреналину. Бета-2-рецепторы равномерно распределены по органам, бета-1 — представлены, главным образом, в миокарде. Однако 50% рецепторов желудочка и предсердия составляет таковые бета-2 подтипа .
Катехоламины, норадреналин и адреналин, конкурируют с экзогенно назначаемым адренергическим препаратом за связь с бета-2-рецепто-ром. К универсальным симпатомиметикам относят препараты, действующие на альфа- и бета-адренорецепторы. В эту группу входят адреналин и эфедрин. Оба препарата характеризуются быстрым и непродолжительным действием, элиминируются через почки. Они медленно ме-таболизируются в печени, причем адреналин — с образованием метаболита с бета-блокирующей активностью.
В настоящее время препараты этой группы в клинике используются достаточно редко. Основным показанием к их назначению остаются острые астматические приступы, анафилактические реакции, эпизоды бронхообструкции, связанные с преобладанием отека слизистой бронхов. Столь узкий спектр показаний для препаратов данной группы обусловлен наличием у них достаточно большого числа побочных эффектов.
Среди неуниверсальных препаратов, т. е. агонистов бета-1 — и бета-2-адренорецепторов, выделяют селективные и неселективные симпато-миметики.
К неселективным симпатомиметикам относят препараты, стимулирующие и бета-1, и бета-2-адренорецепторы. В связи с быстрым и ощутимым эффектом, удобством использования ингаляционных форм эти препараты сразу нашли широкое применение. К неселективным препаратам относят изопреналина гидрохлорид (новодрин, изадрин), орцип-реналина сульфат (алупент, астмопент).
В начале 60-х годов в связи с широкой популярностью и часто бесконтрольным использованием этих препаратов был отмечен факт повышения смертности больных астмой от осложнений медикаментозной терапии.
Агонисты бета-адренорецепторов подразделяются на катехоламины и некатехоламины, соответственно изопротеренол и альбутерол (сальбутамол). Изменения в различных участках структуры бета-агониста позволяют увеличивать бета-2-специфичность и длительность бронходилятации. Бета-2-агонисты длительного действия, обладающие длинными липофильными боковыми цепями, закрепляются в смежном к бета-2-адренорецептору месте, пролонгируя эффективность препарата . При этом объективно достигается максимальный бронходилятирующий эффект при минимизации побочного действия. Идентифицированы гены, отвечающие за вариации бета-адренергического рецептора, что позволяет предположить, что они могут ассоциироваться с ночной астмой или другими особенностями астматического фенотипа .
Несмотря на длительное использование бета-2-агонистов, остается много вопросов и противоречий. Наибольшее количество вопросов связано с увеличением летальности при бронхиальной астме, описанной в виде “эпидемий”. В 1948 г. Benson и Perlman связывали передозировку ингаляций спрея адреналина с кардиотоксичностью и летальными исходами. Далее последовала оценка первого бета-агониста — изопреналина. Наблюдения касались передозировок и развития рефрактерного статуса у больных астмой и смерти, связанной с возрастающим использованием этого препарата. В начале 60-х годов описана самая большая “эпидемия” смертности от астмы, которая наблюдалась преимущественно в Уэльсе, Англии, Новой Зеландии и Австралии. Увеличение смертности с 1 до 3 на 100000 населения за этот период, было связано с появлением на рынке новой формы изопреналина. Van Metre в 1969 г. отметил, что тяжесть астматических атак уменьшается при уменьшении дозы назначаемого изопреналина и применении более активного неселективного бета-агониста — орципреналина. Выявленная взаимосвязь с последующим удалением с фармацевтического рынка этого продукта за относительно короткий период времени привела к снижению летальности до предшествующего уровня. Вторая «эпидемия” смертности от астмы отмечена в Новой Зеландии в конце 70-х — начале 80-х годов. После нескольких аналитических исследований эту эпидемию связали с введением относительно неселективного бета-агониста фенотерола. Выявлена высокая пропорция использования препарата среди тяжелых больных, очевидно не контролируемых другими препаратами.
В 1990 г. опубликовано исследование W.O.Spitzer, в котором был проведен анализ лекарственных назначений у 12301 больных астмой. Был выявлен высокий риск летального исхода, связанный с фенотеролом, сальбутамолом, оральными бета-агонистами и теофиллином. Риск смерти был значительно выше в тех случаях, когда длительность применения сальбутамола превышала 1 мес. Повышение летальности может быть связано с разными механизмами, которые включают нарушения ритма сердца, маскирующие действие бета-агонистов на прогрессирующий воспалительный процесс, отрицательное действие на воспаление в дыхательных путях. Фатальная астма описана у больных, злоупотреблявших использованием бета-агонистов . Мнение специалистов о негативном влиянии некоторых бета-агонистов в нормальных или повышенных дозах не разделяется другими авторами. Анализ тех же самых данных и обзоров приводит этих авторов к совершенно другим, менее тревожным заключениям. Предполагается, что во многих случаях тяжесть заболевания была фактором, предшествующим увеличению частоты использования и доз бета-агонистов . В большинстве случаев таким больным не назначалась противовоспалительная терапия. Однако общим является мнение о том, что увеличение использования бета-агонистов выше стандартных рекомендуемых доз может иметь дополнительный отрицательный эффект и способствовать неблагоприятному исходу заболевания.
Эфедрин. Первые упоминания об использовании лекарственных препаратов симпатомиметического действия (производные эфедры) встречаются за несколько тысячелетий до новой эры. Эфедрин — первый бета-агонист для терапевтического использования. Синтезированный в 1923 г. эфедрин использовали в течение многих лет. Бронходилятирующий эффект у эфедрина непрямой, главным образом через норадреналин, выделяемый из окончаний адренергических нервов . Первоначально эфедрин комбинировали с низкими дозами теофиллина и фенобарбитала для уменьшения побочных эффектов эфедрина на центральную нервную систему. Эфедрин имеет слабый бронхо-дилятирующий эффект и требуются дозы значительно большие (в 2,5- 10 раз), чем у прямо действующих новых оральных симпатомиметиков. Но при больших дозах наблюдаются побочные эффекты, такие как возбуждение, бессонница, тремор конечностей, гипертензия, задержка мочи. В связи с этим в настоящее время у детей эфедрин практически не используется.
Адреналин. Адреналин (эпинефрин) купирует проявления аллергических реакций немедленного типа (анафилактический шок, ангионевротический отек и др.). Препарат оказывает воздействие на альфа, бета-1 и бета-2-рецепторы. Адреналин — первый синтетический бета-агонист. В настоящее время этот препарат используется главным образом для лечения анафилаксии. Наилучший путь введения внутримышечный (действие начинается быстрее, чем при подкожном введении). Адреналин начинает действовать быстро, но эффект непродолжителен. Побочные действия касаются центральной нервной и кардиоваскулярной систем. Детям адреналин в разведении 1:1000 вводят из расчета 0,01 мл/кг (1,0 мг/мл), как правило, не более 0,3 мл 0,1% раствора. Если возникает необходимость та же доза может быть введена повторно с интервалом в 20 минут. У детей до 6 мес. достаточной является доза 0,05 мл, от 6 мес до 6 лет — 0,12 мл, от 6 до 12 лет -0,25 мл, старше 12 лет — 0,5 мл. Обращается внимание, что, адреналин показан больному бронхиальной астмой в случае, если он не может создать пик потока на выдохе [Баранов А.А., 1999].
Изопротеренол. Изопротеренол (изопреналин) был первым препаратом, устойчивым к катехол-о-метилтрансферазе. Препарат назначался ингаляционно, в том числе через небулайзер, сублингвально, парентерально. При ингаляционном пути введения препарат быстро метабо-лизируется с образованием метоксиизопреналина, который в ряде случаев способен вызвать бронхоспазм. Максимальный эффект изопрена-лина наступает уже через 1-3 мин, однако, длится не более 1-1,5 часов. Небулизация 5% раствора в свое время была стандартной терапией обострений бронхиальной астмы . Однако кардиотоксичность изопротеренола, даже в низких дозах, сделали эту терапию непопулярной, и у детей практически не применяемой.
Тербуталин. Тербуталин — бета-2 селективный агонист короткого действия, который используется внутрь, парентерально и в аэрозольной формах. Как и другие селективные бета-агонисты тербуталин резистентен к катехол-о-метилтрансферазе и моноаминоксидазе, что позволяет назначать его различными путями. По сравнению с изопреналином, тербуталин в 2 раза активнее воздействует на тонус бронхиального дерева и значительно слабее на частоту сердечных сокращений. Действие тербуталина после 1 -2 ингаляции (0,25мг) сохраняется 4-4,5 ч . Тербуталин назначается в порошкообразной форме с помощью турбухалера. Тербуталин сульфат (Бриканил Турбухалер) — многоразовый ингалятор сухого порошка. Содержит 0,5 мг в 1 ингаляции. Ингалятор активируется вдохом больного. Создаваемые турбулентные потоки захватывают при вдохе порошок активного вещества, что способствует его проникновению в бронхи. Назначается детям в возрасте старше 3 лет по 0,5 мг (1 доза) по потребности.
Сальбутамол. Сальбутамол — бета-2-агонист короткого действия, применяется с 1968 г. в таблетированной форме, в виде аэрозоля в растворе, дозированном ингаляторе и сухой пудре для ингаляций. Сальбутамол проявляет преимущественно бета-2-агонистическую активность. При оральном назначении бронходилятация развивается в течение 15 мин, с пиком от 2 до 4 ч и продолжительностью до 5 ч. После перорального приема спустя 30 мин препарат определяется в плазме, достигая максимального уровня через 2 ч. Ингаляция 200 мкг сальбутамола вызывает бронходилятацию через 1 мин, которая длится 4-6 ч. При ингаляционном введении только 10-20% введенной дозы достигает дистальных отделов бронхов и альвеол, при этом препарат не подвергается метилированию с участием фермента катехол-о-метилтрансферазы, то есть не трансформируется в метаболиты с бета-блокирующей активностью. Часть дозы, которая остается в дыхательных путях, а также оседает в ротоглотке и проглатывается — всасывается, попадает в системный кровоток, метаболизируется в печени и затем выводится с мочой в неизмененном виде и в виде фенольного сульфата. Степень связывания сальбутамола в белками плазмы составляет 10%.
Сальбутамол применяется с помощью дозирующего ингалятора 100 мкг препарата на каждый вдох (Вентолин, Саламол, Сальбутамол). У детей 2-6 лет разовая доза 100-200 мкг, 6-12 лет — 200 мкг, старше 12 лет — 200-400 мкг назначается не более 3-4 раза в сутки. Для лучшей доставки в дыхательные пути сальбутамол (Вентолин) применяют со спейсером (Бебихалер и Волюматик). Сальбутамол может использоваться через небулайзер, для чего выпускается в специальных пластиковых контейнерах (Вентолин-небулах), содержащих 2,5 мг препарата в виде сальбутамола сульфата в 2,5 мл физиологического раствора. Препарат Вентолин-небулы не предназначен для инъекций, и используется в неразведенном виде. Средняя начальная доза сальбутамола, ингалируемого с помощью небулайзера, у детей старше 18 мес составляет 2,5 мг, минимальная 1,25 мг. При необходимости доза может быть увеличена до 5 мг под контролем врача. Ингаляции можно повторять 4 раза в сутки. Родителей детей, применяющих Вентолин-небулы в домашних условиях, необходимо предупредить, о том, что нельзя самостоятельно увеличивать дозу препарата, это может решить только лечащий врач.
Препарат Вентолин Легкое Дыхание представляет собой дозированный аэрозоль для ингаляций. Выпускается в виде пластйкового футляра с ингаляционным устройством, содержит в одной дозе 100 мкг сальбутамола. Особенность устройства состоит в том, что нет необходимости синхронизировать вдох с нажатием на баллончик. Ингалятор активируется вдохом больного. При вдохе открывается клапан и определенная доза препарата поступает в дыхательные пути.
Сальбутамол также используется в виде порошка для ингаляций (Вен-тодиск, Сальбен) с помощью специального устройства. Вентодиск содержит в 1 дозе 200 мкг или 400 мкг сальбутамола сульфата. Сальбен в 1 дозе содержит 200 мкг сальбутамола. В качестве порошка носителя в этом препарате используется бензоат натрия (9,8 мг), имеющий антисептические, муколитические и противогрибковые свойства. В качестве ингаляционного устройства используется циклохалер.
Среди побочных эффектов сальбутамола следует отметить тахикардию, тремор конечностей, головную боль.
Фенотерол. Фенотерол — дериват метапротеринола - селективный бета-2-агонист короткого действия. Фенотерол быстро абсорбируется после ингаляционного введения. При ингаляционном введении препарат поступает в системный кровоток, как и другие аэрозольные препараты, двумя путями. Первый — мало зависит от ингалируемой дозы и связан с всасыванием препарата со слизистой оболочки дыхательного тракта; другой — зависит от количества проглатываемого препарата, то есть, связан с исходно ингалируемой дозой. Фенотерол не метаболизируется с участием фермента катехол-о-метилтрансфераза. Связывание с белками плазмы составляет 40-55%.
Фенотерол с помощью дозирующего ингалятора назначается детям старше 6 лет. Предпочтение отдается Беротеку-100 с содержанием в 1 ингаляционной дозе 100 мкг препарата. Применение фенотерола в форме Беротек-100 позволяет снизить частоту побочных эффектов и добиться лучшей переносимости препарата.
В сравнительных рандомизированных исследованиях эффективности и переносимости фенотерола и сальбутамола было показано, что фенотерол в дозе 200 мкг оказывает несколько более выраженный бронхолитический эффект по сравнению с фенотеролом и сальбутамолом в дозе 100 мкг. В то же время, как указывалось выше, по переносимости препарат Беротек-200 (200 мкг) значительно уступает Беротеку-100 (100 мкг) и сальбутамолу в дозе 100 мкг . Беротек Н (фенотерола гидробромид) выпускается в дозированном аэрозольном ингаляторе — 100 мкг в одной ингаляционной дозе на основе безопасного, альтернативного фреону газа-носителя гидрофлюороалкана (HFA), который принят Международным Фармацевтическим Аэрозольным консорциумом (IPACT) в качестве оптимального по безопасности и эквивалентного по фармакологическим свойствам наполнителя для дозированных аэрозолей. Во время переходного периода на бесфреоновые дозирующие аэрозоли на фармацевтическом рынке могут находиться одновременно фреон-содержащие лекарственные формы Беротека: Беротек 100 и Беротек Н в дозе 100 мкг в одной ингаляции с альтернативным пропеллентом. Применяются у детей старше 6 лет по 1 -2 ингаляции до 3-4 раз в сутки.
Беротек — раствор для ингаляций содержит в 1 мл 1,0 мг фенотерола гидробромида. У детей 6-12 лет применяется по 0,25-0,5 мл (5-10 капель) раствора. У детей в возрасте до 6 лет имеются ограниченные данные об использовании препарата. Лечение проводится только под медицинским наблюдением, используется доза 50 мкг/кг. Сначала в камеру небулайзера вносят стерильный физиологический раствором в необходимом объеме (1,5-2,0 мл) и затем добавляют соответствующую возрасту дозу беротека. Оставшийся после употребления раствор не используют.
Побочные эффекты беротека не отличаются от других симпатомиме-тиков. Фенотерол вызывает инотропный и хронотропный кардиоваскулярный эффект, сравнимый с изопротеренолом и более выраженный по сравнению с сальбутамолом и тербуталином в эквивалентных дозах .
Бронхиальный тонус определяется преимущественно парасимпатической холинергической иннервацией и при бронхиальной астме значительно усилен, что обусловливает бронхиальную гиперреактивность и рефлекторную бронхоконстрикцию. Нейротрансмиттер ацетилхолин, освобождающийся в нервных окончаниях, воздействуя на холинергические рецепторы, приводит к сокращению гладкой мускулатуры, усиливает секрецию подслизистых желез, вызывает бронхоконстрикцию. При недостаточном бронхолитическом эффекте бета-2-агонистов дополнительное введение ипратропиума бромида, обладающего антихолинергическим действием, приводит к синергическому эффекту. В состав комбинированного препарата Беродуал входит фенотерола гидробромид и ипратропиума бромид. Препарат используется в форме дозированного аэрозоля (в 1 дозе 50 мкг фенотерола и 29 мкг ипратропиума бромида), раствора для ингаляций (1 мл — 20 капель, содержит 500 мкг фенотерола и 250 мкг ипратропиума бромида). Дозированный аэрозоль назначается детям старше 3 лет по 1 -2 дозы 3 раза в сутки. Фенотерол в сочетании с антихолинергическим препаратом обладает высокой эффективностью и низкой частотой побочных эффектов. Раствор бередуала используется для ингаляций через небулайзер у детей в возрасте до 6 лет в дозе 0,5 мл (10 капель) до 3 раз в сутки, детям старше 6 лет -0,5-1,0 (10-20 капель) до 4 раз в сутки. Рекомендуемая доза разводится в камере небулайзера физиологическим раствором до 2,0-3,0 мл.
В конце 80-х годов были созданы два пролонгированных бета-симпатомиметика — формотерол и сальметерол, длительность действия которых достигает 12 ч, что позволяет уменьшить кратность введения до 2 раз в сутки. Продолжительность действия бета-2-агонистов может быть объяснена липофильностью препарата . Формотерол, характеризующийся высокой липофильностью, входит в плазмалемму и удерживается в ней. Одновременно значительное количество препарата, способного раствориться в воде, позволяет достичь немедленного взаимодействия с бета-2-адренорецептором гладкомышечной клетки, что обусловливает быстрое наступление эффекта бронходилятации при приеме формотерола, сходного с бета-2-агонистами короткого действия. Пролонгированный эффект определяется постепенным высвобождением небольших порций формотерола из плазмалеммы.
В отличие от традиционных адреномиметиков, эффект пролонгированных препаратов наступает несколько позже. В связи с этим препараты не предназначены для купирования приступов бронхоспазма, а могут быть рекомендованы для более длительной постоянной терапии с целью предупреждения приступов удушья и обострения заболевания. Однако мнения относительно целесообразности длительного применения пролонгированных симпатомиметиков достаточно противоречивы. Основываясь на данных исследований действия бета-2-агонистов на выделение тучными клетками медиаторов in vitro, сальметеролу и формотеролу приписывается противовоспалительный эффект . Эти препараты ингибировали выделение воспалительных медиаторов из сенсибилизированной легочной ткани, стимулированных альвеолярных макрофагов, снижали активность эозинофилов .
Формотерол. Формотерол — высоко селективный пролонгированный бета-2-агонист с быстрым началом действия. При назначении 12 мкг препарата максимум бронходилятации отмечается через 5 мин и продолжается 12 ч. Используется как для поддерживающей, так и неотложной терапии . Формотерол оказывает значительную защиту против бронхоспазма, вызываемого метахолином, в течение 12 ч и ингибирует бронхоспазм, вызванный физической нагрузкой и гипервентиляцией, в течение 4 ч после ингаляции . В результате сравнительного изучения было показано, что формотерол в течение 12 ч после приема проявляет не меньший бронходи-лятирующий эффект, чем сальбутамол на максимуме своего действия. Через 3-4 ч после приема формотерол оказывается значительно более активным по сравнению с сальбутамолом . Препарат абсорбируется в среднем на 60%, связывается с белками, интенсивно метаболизируется в печени с образованием глюкуронидов. Элиминируется формотерол, в основном в виде метаболитов (до 94% от введенной дозы), количество неизмененного формотерола не превы-шает7-14%. Кумуляции препарата не отмечено .
Препарат формотерола (Оксистурбухалер) — порошок для ингаляций. Применяется у детей с 12 летнего возраста. Каждая ингалируемая доза содержит 4,5 мкг или 9 мкг формотерола фумарата. Эффект наступает через 1-3 мин и продолжается 12 ч. Спустя 4 мин прирост ОФВ1 отмечался у всех больных Оксис применяют для лечения и профилактики обратимой обструкции дыхательных путей, и в комбинации с противовоспалительными препаратами .
Форадил — дозированный аэрозоль формотерола для ингаляций, 1 доза содержит 12 мкг формотерола фумарата. Назначается детям старше 5 лет по 12-24 мкг 2 раза в сутки.
Сальметерол. Сальметерол (Серевент) — селективный бета-2-аго-нист пролонгированного действия. Эффект сохраняется в течение 12 ч. Структура сходна с сальбутамолом, с длинной липофильной боковой цепью, которая закрепляет компонент точно вблизи бета-2-адреноре-цептора, что удлиняет действие препарата.
Липофильность сальметерола в тысячи раз превышает таковую у сальбутамола и других бета-агонистов. В результате препарат быстро проникает в мембрану клетки и далее медленно перемещается вдоль фосфолипидных слоев самого рецептора. Предполагается, что молекула сальметерола преобразуется таким образом, что ее активная часть связывается с тем же участком рецептора, с которым возможно взаимодействие сальбутамола и адреналина и обеспечивает рецепторный механизм действия. Другая часть молекулы сальметерола, длинная гибкая цепочка, проникает глубоко в гидрофобную область мембраны клетки и определяет его фармакологические особенности . По-видимому, этим можно объяснить отличия сальметерола от других бета-агонистов. Связь сальбутамола с рецептором носит конкурентный характер, поэтому быстро подвергается диссоциации, в то время как сальметерол является неконкурентным агонистом. В связи с этим сальбутамол является препаратом с коротким действием, в то время как эффект сальметерола поддерживается в течение длительного времени .
Именно благодаря уникальному механизму действия сальметерола достигается пролонгирование эффекта препарата. Сальметерол оказывает действие локально в легких. Несмотря на применение, недавно разработанного высокочувствительного метода , сальметерол в плазме удается обнаружить только в течение 20-30 мин после ингаляции, в связи с чем полностью охарактеризовать его фармакологический профиль не представляется возможным. При длительном, более 12 мес, использовании сальметерола у больных с обструкцией дыхательных путей не наблюдалось неблагоприятных эффектов .
Сальметерол у больных бронхиальной астмой позволяет снизить повышенную чувствительность к гистамину и метахолину. Следует отметить, что сальметерол, так же как и формотерол, уменьшает ранние и поздние аллергические реакции. Однако анализ клеточного состава крови и бронхиального секрета показал, что степень функциональной активности клеток, определяющих развитие процессов воспаления, не уменьшается на фоне терапии симпатомиметиками. Показано, что сальметерол в системах, чувствительных к действию кортикостероидов, таких как синтез цитокинов фибробластами или апоптоз эозинофилов усиливает действие стероида.
Сальметерол (Серевент) назначают детям старше 4 лет по 25-50 мкг 2 раза в сутки, для этого может быть использован спейсер Волюматик. Наиболее часто сальметерол назначают в дозе 50 мкг 2 раза в сутки, что оказывается оптимальным для больных бронхиальной астмой легкого и среднетяжелого течения. В случае более тяжелого течения заболевания препарат применяют в комбинации с ингаляционными и оральными кортикостероидами, кромогликатом натрия, недокромилом и теофил-лином [Чучалин А.Г. и соавт., 1998]. Сальметерол в дозе 50 мкг обеспечивает значительно больший эффект по сравнению с сальбутамолом в дозе 200 мкг 4 раза в сутки . Обострение бронхиальной астмы при лечении сальметеролом наблюдалось значительно реже, чем при использовании сальбутамола. У детей использование комбинированной терапии ингаляционными кортикостероидами (флютиказон пропионат) и пролонгированными бета-2-агонистами позволяет увеличить эффективность терапии без повышения дозы ингаляционных кортикостероидов [Геппе И.А. и соавт.,1999].
Частота побочных эффектов (головная боль, судороги мышц, тремор, сердцебиение) не отличается от других симпатомиметиков и составляет 1,5-3% при назначении дозы 50 мкг и до 7-8% при дозе 100 мкг.
Спиропент (кленбутерол) — оказывает пролонгированный бронхолитический эффект в течение 12 часов путем селективной стимуляции бета-2-рецепторов. Таблетка содержит 0,02 мг хлоргидрата кленбутерола. Назначают детям старше 12 лет по 1 таблетке 2 раза в сутки. Сироп спиропента (5 мл сиропа содержат 0,005 мг хлоргидрата кленбутерола) назначают детям до 2 лет — 5 мл 2 раза в сутки, 2-4 лет — 5 мл 3 раза в сутки, 4-6 лет — 10 мл 2 раза в сутки, 6-12 лет — 15 мл 2 раза в сутки.
Современная фармакология учитывает направления терапии бронхиальной астмы и использует свойства бета-2-агонистов при создании комбинированных препаратов.
Используется комбинация кромонов с бета-2-агонистами короткого действия (Дитек, Интал-плюс) и комбинации ингаляционных кортикостероидов и пролонгированных бета-агонистов (Серетид).
Дитек. Дитек представляет собой дозированный аэрозоль, содержащий два различных по своим характеристикам активных компонента: селективный бета-2-агонист фенотерол (0,05 мг) и хромогликат натрия (1,0 мг).
Действие симпатомиметика, благодаря связыванию с бета-2-адренорецепторами бронхиальной мускулатуры, приводит к мощному бронхолитическому эффекту, кромогликат натрия оказывает стабилизирующее действие на тучные клетки. Препарат угнетает высвобождение гистамина, хемотаксических факторов и других соединений, тем самым, блокируя аллергическую реакцию немедленного типа. Это в свою очередь предупреждает «запуск» поздней фазы аллергических реакций. В клинических испытаниях было показано преимущество дитека по сравнению с обоими компонентами, взятыми отдельно . По эффективности дитек не уступает Инталу как средству «базисной» или антиаллергической терапии.
Дитек оказывает профилактическое действие и может использоваться как средство базисной терапии за счет комбинации профилактического и терапевтического действия, и как симптоматический препарат при легком приступе. Применяется по 2 дозы 4 раза в день. С целью профилактики бронхоспазма перед контактом с аллергеном или физической нагрузкой ингалируют 2 дозы препарата.
Серетид — ингаляционный препарат для регулярного лечения. Серетид содержит флютиказона пропионат и сальметорол, оказывает противовоспалительное и бронхорасширяющее действие. Выпускается в виде порошка в Мультидиске и в виде гидрофторалканового дозирующего ингалятора. Каждая доза мультидиска содержит 50 мкг сальмете-рола ксинафоата в комбинации со 100 или 250 мкг флютиказона пропионата (соответственно Серетид 50/100 или Серетид 50/250).
Эффективность и безопасность серетида были продемонстрированы в рандомизированных контролируемых исследованиях более чем у 4200 детей и взрослых с бронхиальной астмой различной степени тяжести. Показано, что серетид эффективнее, чем монотерапия каждым из компонентов и столь же эффективен, как и оба препарата, применявшиеся одновременно, но в разных ингаляторах. Есть данные о том, что системные кортикостероиды увеличивают эффективность короткодействующих бета-агонистов, когда появляются начальные признаки толерантности, что, может быть прямо связано с действием кортикостероидов на бета-адренорецепторы. С другой стороны предполагается, что высокие дозы бета-агонистов могут снижать эффективность ингаляционных кортикостероидов .
Данные о взаимодействии двух компонентов препарата определяются различиями в механизмах действия. Боковая цепь молекулы сальметерола взаимодействует с наружной частью мембранных бета-2-рецепторов, вызывая пролонгированный бронхолитический эффект . Флютиказон пропионат связывается с внутриклеточным глюкокортикоидным рецептором и образует активный комплекс “рецептор-стероид”. Данный комплекс в форме димера мигрирует в ядро клетки, связывается со специфическими последовательностями ДНК. Это приводит к танскрипции различных генов, ответственных за синтез противовоспалительных медиаторов, и в конечном итоге к противовоспалительному эффекту. Было показано, что пролонгированные бета-агонисты и кортикостероиды взаимодействуют на молекулярном уровне. Кортикостероиды усиливаюттранскрипцию бета-2-адренергических рецепторов в легких человека и повышают синтез бета-2-рецепторов в слизистой оболочке дыхательных путей . Имеется ряд доказательств, что кортикостероиды снижают десенситизацию и толерантность бета-2-рецепторов , а пролонгированные бета-2-агонисты, в том числе сальметерол, стимулируют (через механизм фосфорилирования) неактивный стероидный рецептор. В результате последний становится более чувствительным к стероид-зависимой активации. Назначают серетид детям в возрасте старше 4 лет с различной степенью тяжести бронхиальной астмы при сохранении симптомов заболевания, при проведении терапии ингаляционными кортикостероидами, а также больным, у которых, при регулярном применении бронходилятаторов и кромонов, имеется необходимость в использовании ингаляционных кортикостероидов. Использование комбинированного препарата приводило к значительному улучшению функции легких, обеспечивало надежный контроль симптомов астмы, по сравнению с удвоением дозы ингаляционного кортикостероида . Исследование функции надпочечников при лечении серетидом свидетельствовало об отсутствии влияния на систему гипоталямус-гипофиз-надпочечники . Показана хорошая переносимость препарата у детей. Среди побочных проявлений у детей, получавших серетид, отмечено раздражение слизистой оболочки глотки (6%), головная боль (6%) и кандидоз (4%) .
Пути введения. Бета-2-агонисты могут назначаться внутрь, в ингаляциях или парентерально. Ингаляции у детей из дозирующего аэрозольного ингалятора со спейсером или через небулайзер дают оптимальный терапевтический эффект. Назначение бета-2-агонистов с использованием спейсера позволяет доставлять повторные дозы, суммарно эквивалентные таковым при использовании небулайзера . В связи с отрицательным действием хлорфлюорокарбонов на озоновый слой, и в соответствии с Монреальским протоколом (1986), в дозированных аэрозольных ингаляторах фреон заменяется на пропелленты, не повреждающие озоновый слой. Разрабатываются и совершенствуются другие средства доставки: сухие дозирующие ингаляторы, небулайзеры, ингаляторы “легкое дыхание”. В 1997 г. в России принята Национальная программа “Бронхиальная астма у детей. Стратегия лечения и профилактика”. Программа направлена на улучшение диагностики и лечения детей с бронхиальной астмой. Важное место занимает терапия обострений у детей с бронхиальной астмой, которая нередко осуществляется врачами скорой помощи. В современной практике широко используют аэрозольную терапию, что связано с возможностью быстрой доставки препаратов вдыхательные пути, высокой местной активностью, уменьшением побочных системных эффектов. Ее использование может быть затруднено в связи с тяжестью состояния либо возрастными особенностями. В связи с этим в последние годы все более широкое распространение в лечении обострения бронхиальной астмы получает небулайзерная терапия.
Небулайзерная терапия проводится с помощью специального прибора небулайзера, состоящего из собственно небулайзера и компрессора, создающего поток 4-6 л/мин для распыления частиц препарата размером 2-5 мкм.
Небулайзерная терапия не требует координации ингаляции с дыханием и позволяет создать высокие концентрации лекарственного вещества в легких. Цель небулайзерной терапии состоит в доставке терапевтической дозы препарата в аэрозольной форме и получении фармакодинамического ответа за короткий период времени.
Общий объем распыляемого препарата через небулайзер составляет 2-3 мл, поэтому первоначально в небулайзер заливается физиологический раствор 1 -1,5 мл, а затем добавляют необходимую дозу бронхоспазмолитика.
Предпочтение отдается ингаляции через рот, при этом ребенок дышит через мундштук, но у детей первых лет жизни может использоваться специально подобранная плотно прилегающая маска. Продолжительность ингаляции 5-10 мин, до полного прекращения распыления препарата.
В лечении детей небулайзерная терапия занимает особое место, в связи с легкостью проведения, высокой эффективностью, возможностью применения с первых месяцев жизни. Небулайзерная терапия используется при любой степени тяжести приступа. В то же время необходимо помнить, что при лечении больного ребенка должны быть учтены, как особенности течения заболевания предшествующие обострению, так и самого обострения.
Системные эффекты бета-2-агонистов. Системные эффекты бета-2-агонистов являются дозозависимыми и могут сопровождать улучшение бронхиальной проходимости после ингаляции препарата. Системная абсорбция наблюдается через легочное сосудистое русло, липофильные компоненты более быстро абсорбируются из желудочно-кишечного тракта.
Гипокалиемия. В основном гипокалиемия отмечается при системном назначении бета-агонистов, но также может быть при ингаляции высоких доз . Гипокалиемия является результатом внутриклеточного перехода калия в скелетную мышцу, вследствие стимуляции бета-агонистом мембранной натрий/калий-АТФазы. Есть данные, о внутриклеточном перемещении ионов калия через стимуляцию панкреатических бета-2-рецепторов, что ведет к увеличению концентрации инсулина . Внеклеточная концентрация ионов калия является наиболее важной причиной миокардиальной стабильности. Поэтому при назначении высоких доз бета-2-агонистов возможна сердечная аритмия, удлинение интервала QT на ЭКГ . Гипокалиемический эффект бета-2-агонистов может усиливаться одновременным назначением кортикостероидов, диуретиков, теофиллина.
Гипоксия. Назначение бронхоспазмолитиков может усиливать гипоксию . Снижение РаO2 наблюдается в течение 5 минут после назначения бронхолитика. Хотя гипоксия является транзиторной и умеренной, при тяжелой астме ее усиление может увеличить изменения в миокарде.
Метаболические нарушения. При назначении бета-2-агонистов наблюдается снижение в сыворотке магния, кальция и фосфора, что возможно связанно с увеличением уровня циркуляции инсулина .
Миокардиальная токсичность. Бета-агонисты увеличивают силу сокращения сердечной мышцы (инотропный эффект) и частоту сокращения (хронотропный эффект) через действие на бета-рецепторы. При этом наблюдается увеличение сердечного выброса, и потребления миокардом кислорода. Этот эффект может быть минимизирован использованием селективных бета-2-агонистов. При злоупотреблении бета-2-агонистами могут наблюдаться значительные гемодинамические эффекты, такие как увеличение сердечного выброса, ударного объема . Лечение кортикостероидами предотвращает такие нарушения .
Воздействие на центральную нервную систему. Селективные бета-агонисты не вызывают значительной стимуляции центральной нервной системы, так как они не проходят через гематоэнцефалический барьер.
Скелетная мускулатура. Тремор конечностей является дозо-зависимым феноменом системного назначения бета-2-агонистов.
Парадоксальный бронхоспазм. Парадоксальный бронхоспазм наблюдается после использования бета-агонистов у отдельных пациентов, злоупотребляющих аэрозольными дозирующими ингаляторами . Рефлекторный бронхоспазм может быть следствием раздражающего эффекта аэрозольного устройства или бета-адренергической тахифилаксии.
Тактика применения бета-2-адреномиметиков. Бета-2-агонисты представляют собой первую линию терапии бронхоспазма при легкой, среднетяжелой и даже тяжелой астме, нередко обеспечивают обратимость бронхоспазма. Ингаляционные бета-агонисты короткого действия являются оптимальными препаратами для купирования приступов удушья и предупреждения обострений бронхиальной астмы, бронхоспазма, вызванного физической нагрузкой. В том случае, когда больной получает плановую терапию и при этом сохраняется необходимость в дополнительном назначении ингаляционных симпатомиметиков, чаще всего стоит вопрос о неадекватности проводимой терапии. Использование ингаляционных симпатомиметиков должно сводиться к минимуму и назначать их следует по потребности в качестве средства “скорой помощи”, так как течение медикаментозно контролируемой бронхиальной астмы, как правило, не требует их частого применения. Считается, что регулярное использование бета-агонистов короткого действия недостаточно для обеспечения адекватного контроля за симптомами астмы, вариабельностью пиковой скорости выдоха и бронхиальной гиперреактивностью .
Основу терапии составляют противовоспалительные препараты с эпизодическим назначением бета-агонистов «по потребности». Эффективность бета-2-агонистов часто обеспечивает больных ложным чувством улучшения, что ведет к прерыванию противовоспалительной терапии. Осторожность в назначении бета-агонистов на регулярной основе определяется предположением о развитии тахифилаксии к бронходилятаторам или уменьшении способности бета-2-агонистов вызывать защиту против бронхоспазма, вызванного другими стимулами . При повторном использовании бета-агонистов возможно ухудшение течения заболевания и возрастание бронхиальной гиперреактивности . С чем связаны изменения в снижении бронходилятирующего эффекта, длительности действия — не ясно. Регулярное лечение больных с легкой бронхиальной астмой бета-агонистами сочетается с увеличением вариабельности пиковой скорости выдоха, падением объема форсированного выдоха, увеличением бронхиальной реактивности к гистамину по сравнению с периодом до лечения . Такие изменения наблюдаются при использовании тербуталина, фенотерола и сальбутамола, а также, предположительно, препаратов всего класса бета-агонистов . Механизм этих изменений неясен. Предполагается десенситизация бета-рецепторов с уменьшением релаксации гладких мышц и увеличением выделения медиаторов, уменьшение количества и функционального состояния бета-рецепторов , однако другие авторы считают, что это связано не с десенситизацией, а с увеличением экспозиции аллергенов после бронходилятации и последующим увеличением бронхиальной гиперреактивности .
В литературе последних лет активно дискутируется возможность постоянного, регулярного использования бета-2-агонистов и преимущества такого назначения перед эпизодическим их использованием. В настоящее время трудно сказать, насколько справедлива такая точка зрения. Ответить на этот вопрос пока не представляется возможным без проведения дальнейших многоцентровых исследований. В соответствии с GINA и Национальной программой “Бронхиальная астма у детей. Стратегия лечения и профилактика” с позиций ступенчатого подхода к лечению даже при легкой бронхиальной астме у детей, если требуется частое (более 3 раз в неделю) назначение бета-2-агонистов, рекомендуют коррекцию противовоспалительной терапии.
Первичная помощь на амбулаторном этапе включает при легком и средне-тяжелом обострении ингаляции бета-2-агонистов короткого действия по возможности — через спейсер большого объема (с лицевой маской у детей раннего возраста) до 10 ингаляций (1 вдох каждые 1530 с), или через небулайзер. При тяжелом приступе предпочтение отдается небулайзерной терапии. Используются бета-2-агонисты периодически с интервалом 20-30 мин в течение часа, затем каждые 4 ч по необходимости. Бронхоспазмолитический эффект может быть усилен добавлением ипратропиума бромида.
В настоящее время с созданием пролонгированных бета-агонистов рекомендуется сочетать эти препараты с противовоспалительной терапией.
Хотя механизмы бронхиальной гиперреактивности при бронхиальной астме еще изучаются, главной причиной ее считается наличие воспаления в дыхательных путях. В связи с этим противовоспалительная терапия при легкой и средне-тяжелой астме включает кромогликат и недо-кромил натрия, при средне-тяжелой и тяжелой бронхиальной астме -ингаляционные кортикостероиды. Базисная противовоспалительная терапия уменьшает воспалительный процесс, а бронхоспазмолитики облегчают бронхоспастические реакции.
При назначении ингаляционных симпатомиметиков следует пристальное внимание уделять технике проведения ингаляций. До введения препарата больной должен сделать глубокий выдох. Вдох должен осуществляться медленно за 1-2 с до нажатия на клапан ингалятора так, чтобы оно приходилось на момент максимальной скорости вдоха. После ингаляции препарата необходима задержка дыхания на 5-10 с.
Проблема синхронизации вдоха с моментом поступления лекарственного препарата оказалась одной из самых важных. Некоторые больные дети оказываются не в состоянии освоить и правильно выполнять дыхательный маневр. Таким больным рекомендуют использовать специальные приспособления типа спейсеров, индивидуальных ультразвуковых ингаляторов (небулайзеров), либо переходить на ингаляции лекарственных препаратов в порошкообразной форме с помощью спинхалеров, дискхалеров и турбохалеров.
Таким образом, изложенное позволяет заключить, что бета-2-агони-сты являются одним из основных средств в лечении бронхиальной астмы и применяются для купирования приступов бронхоспазма (ингаляционные формы короткого действия), и в качестве профилактического средства для предупреждения ночных приступов удушья и обострения самого заболевания (пролонгированные препараты).
Антагонисты холинэргических рецепторов. Холинэргические антагонисты на современном этапе широко используются в лечении обструктивных болезней дыхательных путей. Вегетативная иннервация дыхательных путей в норме обеспечивается преимущественно парасимпатической нервной системой через волокна вагусного нерва. В легких ветви вагусного нерва широко представлены в перибронхиальных ганглиях, наиболее часто располагающихся около крупных бронхов. Иннервация слизистых желез, клеток гладкой мускулатуры, легочных артериальных и цилиарных эпителиальных клеток осуществляется через постганглионарные волокна, которые поставляют ацетилхолин и способны активировать мускариновые рецепторы в легких .
Активация этих рецепторов приводит к увеличению продукции слизи, спазму гладкой мускулатуры и увеличению биения ресничек. Холинэр-гический тонус является преобладающим контролирующим фактором при нормальной физиологии легких.
Небольшое количество эфферентных нервных волокон представляет неадренергическую нехолинергическую нервную систему (пуринерги-ческие ветви). Медиаторы этой нервной системы включают вазоактивный интестинальный пептид, пептид гистидин, метионин, которые присутствуют вместе с ацетилхолином в нервных окончаниях. Медиаторы, выделяемые после стимуляции пуринегических окончаний, противодействуют спазму гладкой мускулатуры, оказывая бронхолитический эффект, противоположный эффекту ацетилхолина, выделяющемуся из парасимпатических нервных окончаний.
Холинэргические нервы являются главным бронхоконстрикторным нервным механизмом у животных и человека. Холинэрические нервы поднимаются в ствол мозга и спускаются в виде вагусного нерва, переходя в ганглии, расположенные в стенке дыхательных путей. Из этих ганглиев короткие постганглионарные волокна подходят к гладким мышцам и подслизистым железам. При стимуляции вагусного нерва выделяется ацетилхолин, который активирует мускариновые рецепторы в гладких мышцах и подслизистых железах, в результате развивается бронхокон-стрикция и увеличивается продукция слизи. Мускариновые рецепторы регулируют секрецию слизи, как из подслизистыхжелез, так и из эпителиальных слизистых клеток дыхательных путей .
Ирритантные рецепторы и немиелинизированные С-волокна локализуются в дыхательных путях. Такие же рецепторы находят в пищеводе, верхних дыхательных путях. Рефлекторное раздражение ингаляционными воздействиями, включая холодный воздух, гистамин, другие ирритан-ты, может включать аксон-рефлекс. По афферентным путям импульс поступает в ствол мозга и затем возвращается по вагальным эфферентным путям в дыхательные пути. Потенциально вагальный рефлекс может существенно уменьшаться с помощью антихолинэргических препаратов. Антихолинэргические препараты ингибируют активность ацетилхолина в мускариновых рецепторах и, таким образом, ограничивают холинергическую активность, ответственную за бронхомоторный тонус. Однако, антихолинэргические препараты вызывают только частичную обратимость обструкции при большинстве легочных заболеваний, так как не только холинергические пути ответственны за возникновение бронхокон-стрикции. В случае бронхоспазма, вызываемого физической нагрузкой, гипервентиляцией, холодным воздухом эти препараты эффективны менее чем бета-2-агонисты .
Подтипы мускариновых рецепторов в дыхательных путях. На основе фармакологических исследований и использования специфических ДНК-проб распознается пять подтипов мускариновых рецепторов, но их точное расположение в дыхательных путях и роль в терапии точно не определены .
Мускариновые рецепторные подтипы в дыхательных путях выполняют различные функции (табл. 14-1). М1 -рецептор локализуется в альвеолярной стенке, способствует нейротрансмиссии через парасимпатические ганглии и усиливает холинергические рефлексы. М2-рецепторы действует как ауторецепторы на постганглионарные холинергические нервы и ингибируют выделение ацетилхолина. Получены некоторые данные о том, что эти процессы могут быть нарушены при бронхиальной астме (как последствие воспаления в дыхательных путях) и могут увеличивать холи-нэргическиерефлексы . М2-рецепторы вызывают спастический ответ гладкой мускулатуры дыхательных путей через гидролиз фосфоинозитида, и являются преобладающими рецепторами подслизистых желез и эндотелия сосудов в дыхательных путях. М4- и М5-рецепторы не определяются в дыхательных путях, но в легких кролика М4-рецепторы выделены в альвеолярной стенке и на гладких мышцах. Антихолинергические средства, которые селективно блокируют М3- и М1-рецепторы могут быть успешно использованы как неселективные антагонисты обструкции дыхательных путей.
Таблица 14-1
| Тип рецептора | Локализация | Функция |
| М1 | Парасимпатические ганглии | Нейротрансмиссия |
| Подслизистые железы | Увеличение секреции? | |
| Стенка альвеол | ||
| М2 | Постганглионарные холинергические нервы | |
| Антагонизм бронходилятации | ||
| Симпатические нервы | Ингибиция выделения норадреналина | |
| М3 | Гладкая мускулатура дыхательных путей | Спазм |
| Подслизистые железы | Увеличение секреции слизи | |
| Эпителиальные клетки | Увеличение биения ресничек? | |
| Слизистые клетки? | Увеличение секреции | |
| Эндотелиальные клетки | Вазодилятация через выделение оксида азота | |
| М4 | Стенка альвеол | |
| Гладкая мускулатура у кроликов | ||
| Постганглионарные холинэргические нервы? | Ингибиция выделения ацетилхолина | |
| M5 | Еще не идентифицированы в легких |
Холинэргические нервные механизмы могут играть роль в сужении дыхательных путей при бронхиальной астме и хронической обструктивной болезни легких. Холинэргический бронхоконстрикторный рефлекс может провоцироваться при бронхиальной астме воспалительными медиаторами, такими как брадикинин, который активирует сенсорные нервные окончания в дыхательных путях. В связи с тем, что антихолинергические препараты эффективны в лечении обострений при бронхиальной астме, предполагается, что холинергические механизмы задействованы в развитии обострений заболевания.
Экспериментальные исследования показали, что вирус гриппа и основной белок эозинофилов могут ингибировать М2-рецептор скорее, чем МЗ-рецептор. Это может объяснить усиление роли холинэргического рефлекса в развитии бронхоконстрикции при обострении астмы, вследствие заражения вирусом или экспозиции аллергена. Вирусная инфекция нарушает функции М2-холинэргической рецепции не только в связи с развитием воспалительных изменений, но и путем прямого воздействия продуктов репродукции вирусов на состояние рецепторного аппарата клеток эпителия .
Антихолинергическая терапия. Главная функция холинэргических волокон заключается в усилении бронхомоторного тонуса, увеличении выделения секрета подслизистыми железами, усилении цилиарной активности эпителиальных клеток. Так как большинство мускариновых рецепторов и холинэргической иннервации сосредоточены в центральных дыхательных путях, действие антихолинергических препаратов в основном направлено на снижение бронхоспазма центральных дыхательных путей . Холинергическая активация оказывает существенное влияние на формирование бронхообструктивного синдрома, что связано не только с вагусными влияниями на бронхомоторный тонус, но и с участием этой системы в регуляции дыхания. Рассматривается также участие этой системы в формировании бронхиальной гиперреактивности.
Антихолинергические препараты варьируют от растительных алкалоидов, включая атропин, до неселективных антагонистов мускариновых рецепторов. Препараты атропинового ряда имеют ряд серьезных побочных эффектов со стороны различных органов и систем, легко проникают через гематоэнцефалический барьер, что ограничивает их использование у детей.
Ипратропиум бромид. Прогресс в антихолинергической терапии связан с появлением ипратропиума бромида (Атровент), обладающего низкой абсорбцией с поверхности слизистой оболочки. В связи с этим при ингаляционном применении системный эффект ипратропиума бромида минимален. Ипратропиума бромид ингибирует систему цикпического-гуанозин-3,5,-монофосфата в парасимпатических нервных окончаниях. Максимальная плотность холинергических рецепторов определяется на уровне крупных и несколько меньше — средних бронхов. Ипратропиума бромид характеризуется высокой конкурентной активностью по отношению к нейромедиатору ацетилхолину. Ипратропиума бромид по сравнению с атропином обладает большей избирательностью (в 1,4-2 раза) в отношении мускариновых рецепторов и меньшим подавлением слизеобразования. Биодоступность при ингаляционном пути введения составляет не более 10%. Действие проявляется через 5-25 мин после ингаляции и достигает максимума через 30-180 мин (в среднем -90 мин). Период полувыведения оставляет от 3 до 4 ч, с продолжительностью действия до 5-6 ч .
Атровент выпускается в форме аэрозоля (в одной дозе 0,02 мг) и раствора для ингаляций (0,025% раствор, 1 мл содержит 0,25 мг препарата). Ипратропиума бромид входит в состав беродуала, представляющего комбинацию фенотерола и ипратропиума бромида в форме дозирующего аэрозоля и раствора для ингаляций через небулайзер. Одна доза беродуала содержит 0,05 мг фенотерола и 0,02 мг ипратропиума бромида.
Ипратропиума бромид — неселективный антагонист мускариновых рецепторов. Он не имеет существенных токсических эффектов и поэтому используется у детей с бронхообструкцией как самостоятельно, так и в комбинации с бета-2-агонистами, усиливая эффект симпатомиме-тиков. Полезность ипратропиума бромида в педиатрии показана с начала 80-х годов. Доза ипратропиума бромида для всех возрастов при использовании через небулайзер составляет 250 мкг (детям в возрасте до 1 года — половинная доза). У детей с бронхиальной обструкцией ипратропиума бромид — единственный бронхолитик, который может обеспечить эффект без риска развития гипоксемии . Ипратропиума бромид может эффективно использоваться при острых бронхиолитах, при отсутствии ответа на другой бронхолитик. Препарат дает положительный эффект у детей с бронхолегочной дисплазией . Ипратропиума бромид может применяться в сочетании с симпатомиметиками. Анализ данных литературы с использованием мета-анализа за период 1966-1992 гг. показал, что добавление ипратропиума к бета-2-агонистам у детей приводит к статистически более значимому улучшению ОФВ1, но существенно не влияет на длительность пребывания в больнице, частоту госпитализации . Исследование дозозависимой кривой показало, что оптимальной является доза более 75 мкг. Ипратропиума бромид дает дополнительный положительный эффект при добавлении к сальбутамолу в виде значительного повышения ОФВ1 уже через 1 ч после применения . У детей в возрасте 5-17 лет использование высоких доз сальбутамола и ипратропиума бромида при тяжелой астме оказалось более эффективным и безопасным, чем одного сальбутамола . F.Quereshi и соавт. (1998) в рандомизированном двойном слепом плацебо-контроли-руемом исследовании показали, что добавление ингаляций ипратропиума бромида через небулайзер (500 мг в 2,5 мл) уменьшало частоту госпитализации детей. Также отмечено значительное улучшение легочной функции у детей с тяжелой бронхиальной астмой, получавших дополнительно ипратропиума бромид. LH.PIotnick и F.M.Ducharme (1998) провели отбор рандомизированных контролируемых испытаний по нескольким базам данных MEDLINE (с 1966 по 1997 гг.), EMBASE и CINAHL, посвященных сравнению эффективности одной или нескольких доз ингалируемых антихолинергических препаратов в сочетании с бета-2-агонистами и монотерапии бета-2-агонистами при приступах бронхиальной астмы у детей от 18 мес до 17 лет. Показано, что у детей с тяжелыми приступами подключение нескольких доз бета-2-агонистов в комбинации с антихолинергическим препаратом ипратропиума бромидом были эффективны и безопасны.
Для небулайзерной терапии у детей эффективно используется комплексный препарат беродуал, в состав которого входит фенотерол (500 мкг) и ипратропиума бромид (250 мкг) . Сочетание бета-агониста, имеющего быстрый эффект (5-15 мин),
и ипратропиума бромида (максимальный эффект через 30-90 мин) позволяет получить быстрый и пролонгированный эффект, превышающий действие монокомпонентных препаратов . Для небулайзера раствор беродуала (1 мл — 20 капель) смешивали с физиологическим раствором для получения объема 2,0-4,0 мл. У детей в возрасте 6-14 лет используют 0,5-1,0 мл (10-20 капель), что в большинстве случаев является достаточным для улучшения состояния. В тяжелых случаях может потребоваться доза 2,0 мл (40 капель), которая ингалируется под наблюдением врача. Если необходимо, беродуал назначается повторно, до 4 раз в день. Детям в возрасте до 6 лет рекомендуется 25 мкг ипратропиума бромида и 50 мкг фенотерола (2 капли) на кг массы тела, но не более 0,5 мл (10 капель) 3 раза в день. Продолжительность ингаляции в зависимости от возраста варьирует от 5 до 10 мин.
Ипратропиума бромид используется в лечении легких и средне-тяжелых приступов бронхиальной астмы. При тяжелых обострениях ипратропиума бромид дает дополнительный бронхоспазмолитический эффект. Назначается до 4 раз в день с интервалом 4-5 ч с пиком бронходилятации через 60 мин.
Литература
- Баранов А.А. Неотложная терапия бронхиальной астмы у детей. Пособие для врачей. -М. -1999.
- Геппе Н.А., Колосова Н.Г., Бунатян А.Ф. и др. Дифференцированный подход к назначению ингаляционных кортикостероидных препаратов при бронхиальной астме у детей. // Пульмонология. — 1999, № 4.
- Геппе Н.А., Фаробина Е.Г., Кулешов В.Н. Бронхолитическая активность беротека и беродуала при бронхиальной астме у детей. / Мат. ХУ симпозиума соц. стран по проблемам детской пульмонологии. — Киев, 1989. — С. 97-98 Гусаров А.М., Коростовцев Д.С., Макарова И.В. и др. Современное лечение детей с бронхиальной астмой в остром приступе, астматическом статусе на догоспитальном этапе и в приемном отделении стационара. // Аллергология. — 1999, №2. — С. 42-50. Национальная программа “Бронхиальная астма у детей. Стратегия лечения и профилактика”. — М.- 1997.
- Чучалин А.Г., Черняк Б.А., Медникова Р.Б., Беда М.В. Эффективность сочетанного применения флютиказона пропионата и сальметерола при 18-месячной терапии больных стероидозависимой бронхиальной астмой. // Пульмонология. — 1998, №3. — С. 64-70.
- Ahkquist R.P. A study of adrenotropic receptors. // Am.J Physiol. — 1948. -153. — p. 586. Anenden V., Egemba G., Kessel B. et al. Salmeterol Facilitation of fluticasone-induced apoptosis in eosinophils of asthmatics pre- and post-antigen challenge. // Eur Resp J. -1998. -12. — 157s.
- Arvidsson P., Larsson S., Lofdahl C.G. et al. Formoterol, a new long-acting bronchodilator for inhalation. // Eur Respir J. — 1989. — 2. — p. 325.
- Aubier М., Pieters W., Schlosser N.J.J. et al. Salmeterol/fluticasone propionate (50/500mcg) in combination on a Diskus inhaler (Seretide) is effective and safe in the treatment of steroid dependent asthma. // Respir Med. — 1999. — 93 (12). — p. 876-884.
- Baraniuc J.N., Ali M., Brody D. et al. Glucocorticoids induce beta-2-adrenergic receptor function in human nasal mucosa. // Am J Respir Crit Care Med. — 1997. — 155. — p. 704-710.
- Barnes P.J. B-adrenoreceptors in smooth muscle, nerves and inflammatory cells. // Life Sci.- 1993.- 52.-p.2101.
- Barnes P.J. Neural mechanisms in asthma. In Holgate ST, Austen KF et al. (eds): Asthma Physiology, Immunopharmacology and Treatment-4,h International Symposium. -Academic Press, San Diego. — 1993. — p. 259-273.
- Bekc R. Use of ipratropium bromide by inhalation in treatment of acute asthma in children. // Arch. De Pcdiatrie. — 1995. — 2 Supple 2. — p. 1453-1483.
- Bowton D.L., Goldsmith W.M., Haponik E.F. Substitution of metered-dose inhalers for hand-held nebulizers. Success in cost-saving in a large acute care hospital. // Chest. -1992,- 101.-p. 305-308.
- Chung -K.-F. The complementary role of glucocorticocorticosteroids and long-acting beta-adrenergic agonists. // Allergy. — 1998. -53 (42Suppl). — p. 7-13.
- Colacone A., Afilalo M. A comparison of albuterol administered by metered dose inhaler (and holding chamber) or wet nebulizer in acute asthma. // Chest. — 1993. — 104. — p. 835-841.
- Crane J., Burgess C., Baesley R. Cardivascular and hypokalemic effects of inhaled salbutamol, fenoterol and isoprenaline. // Thorax. — 1989. — 44. — p. 136.
- Dahl R., Pedersen B., Vcnge P. The influence of inhaled salmeterol on bronchial inflammation: a bronchoalveolar lavage study in patients with bronchial asthma. // Am Rev Respir Dis. — 1991. — 143 (supple). — p. A 649.
- Eickelberg O., Roth M., Lorx et al. Ligand-indipendent activation of glucocorticoid receptor by b-2-adrenergic receptor antagonists in primary human lung fibroblastst and vascular smooth muscle cells. // J Biol Mol Chem. — 1999. — 274(2). — p. 1005-1010.
- Fanta C.H., Rossing T.H. McFadden E.R. Treatment of acute asthma is combination therapy with sympathomimetics and methylxanthines indicated. // Am J Med. — 1986. — 80 (1). -p. 5.
- Green S.A., Spasoff A.P., Coleman R.A. et al. Sustained activation of a G protein couple receptor via ‘anchored’ agonist binding: molecular localization of the salmeterol exosite within the beta2-adrenergic receptor. // J. Biol. Chem. — 1996. — 271. — p. 24029-2435 .
- Gross N.J. Anticholinergoc agents. In Weiss EB, Stein M (eds) Bronchial Asthma. — Little, Brown and Co, Boston. — 1993. — p. 876-883 .
- Guidelines for the diagnosis and management of asthma. — National Institute of Health. EPR 2. -NIH Publ. № 97-4051 A. 1997. — p. 29-49.
- Higgins R.M., Cookson W.O. Lane D.J. et al. Cardiac arrhythmia caused by nebulized beta-agonist therapy. // Lancet. — 1987. — 2. — p. 863.
- Jedrys U., Kurzawa R. et al. Evaluation of bronhodilatory activity of berodual and its components: fenoterol and ipratropium bromide in children with bronchial asthma. // Pneumologia: Allergologia. Polska. — 1994. — 61(11-12). -p. 615-22.
- Johnson M. The pharmacology of salmeterol. // Lung. — 1990. — 168 (supple). — p. 115.
- Johnson M. The (3-adrenoreceptor. // Am J Resp Crit Care Med. — 1998. — 158. — p. 146-153.
- Jones A.E., Callejas S., Sadre K. et al. The determination of drugs for the treatment of asthma in plasma by automated solid phase extraction and LC-MC-MS. Proceeding of the 45lh. ASMS conference on mass spectrometry and allied topics. Palm Springs 1997. -p. 560 .
- Kelsen S.G., Church N.L., Gillman S.A. et al. Salmeterol added to inhaled corticosteroid therapy is superior to doubling the dose of inhaled corticosteroids: a randomized clinical trial. //J Asthma. — 1999. — 36. — p. 703-715.
- Liggett S.B., Raymond J.R. Pharmacology and molecular biology of adrenergic receptors.In Bouloux PM (ed): Catecholamines. Ballieres Clinical Endocrinology and Metabolism. Vol 7. — WB Sauders Co, London. — 1993. — p. 279.
- Lofdahl C.G., Chung K.F. Long-acting b2-adrenoreceptor agonists: a new perspective in the treatment of asthma. // Eur Respir J. — 1991. — 4. — p. 218-226.
- Lonky S.A., Tisi G.M. Determining changes in airflow caliber in asthma: the role of submaximal expiratory flow rates. // Chest. — 1980. — 77. — p. 741.
- Mak J.C., Nishikawa M., Barnes P.J. Glucocorticosteroids increase b2-adreneggic receptor transcription in human lung. // Am J Phisiol. — 1995. -268. — L41-46.
- McAlpine L.G., Thomas N.C. Prophylaxis of exercise-induced asthma with inhaled formoterol, a long-acting beta2-adrenergic agonist. // Respir Med. — 1990. — 84. -p. 293.
- Me Fadden E.R. The beta 2-agonists controversy revisited. //Ann Allergy Asthma Immunol. — 1995. — 75(2).-p. 173-6.
- Moler F.W., Hurwitz M.E., Custer J.R. Improvement in clinical asthma score and PaCo2 in children with severe asthma treated with continuously nebulized terbutaline. // J Allergy Clin Immunol. — 1988. — 81. — p. 1101.
- National Asthma Education Program: Gideline for Diagnosis and Management of Asthma. -National Fleart, Lung and Blood Institute. US Department of Health and Human Services publication 91-3042, 1991.
- Nelson H.S., Spector S.L. et al. The bronchodilator response inhalation of increasing doses of aerosolized albuterol. // J Allergy Clin Immunol. — 1983. — 72. — p. 371.
- Osmond MN., Klassen TP. Efficacy of ipratropium bromide in acute childhood asthma: a meta-analysis. // Academic Emergency Med. — 1995. — 2 (7). — p. 651-6.
- Qureshi F., Pestian J., Davis P. Effect of nebulized ipratropium on hospitalization rates of children with asthma.//N Engl J Med. — 1998. — 8. — 339(15). — p. 1030-5.
- Palmqvist M., Persson G., Lazer L., et al. Inhaled dry powder formoterol and salmeterol in asthmatic patients onset of action, duration of effect and potency. // Eur Resp J. — 1997. -v. 10. — p. 2484-2489.
- Plotnick L.H., Ducharme F.M. Should inhaled anticholinergics be added to b2-agonists for treating acute childhood and adolescent asthma. A systematic review. // BJM. — 1998. -317.-p. 971-7.
- Phillips P.J., Vedig A.E., Jones P.L. et al. Metabolic and cardiovascular side effects of the b2-adrenoreceptor agonists salbutamol and rimterol. // Br J Clin Pharmacol. — 1980. — 9. -p. 483.
- Richardson J.B. Innervation of the lung. // Eur J Resir Dis 1982. — 117, Supple. — p. 13.
- Roth M., Eickelberg O., Kohler E. et al. Ca2+ channel blockers modulate metabolism of collagens within the extracellular matrix. // Proc Nat Acad Sci USA. — 1996. -93. — p. 5478-5482.
- Rubin B.K., Alers G.M. Use of anticholinergic in children. // Am. J.Med. — 1996. — 129. -100(1 A). — p. 49S-53S .
- Sears M.R., Taylor R.D., Print C.G. et al. Regular inhaled B-agonist treatment in bronchial asthma. // Lancet. — 1990. -336. — p. 1391-1396.
- Sharma R.K., Edwards K., Hallet C. et al. Perception amongst pediatric patients of the Diskus inhaler, a novel multidose powder inhaler for use in the treatment of asthma. Comparison with the turbuhaler inhaler.//Clin Drug Invest. — 1996.- 11.-p. 145-153.
- Shefer A.L., Arm J.P. Sympatomimetic and Cholinergic Agents and Antagonists. In: Allen P. Kaplan (2nd ed). — Allergy. — 1997. — p. 664.
- Silverman M. The role of anticholinergic Antimuscarinic Bronchodilator Therapy in Children. // Lung. — 1990. — p. 304-309.
- Schuh S., Jonson D.W., Callahan S. et al. Efficacy of frequent nebulized ipratropium bromide added to frequent high-dose albuterol therapy in severe asthma. // J. Pediatrics. — 1995. — 126 (4).-p. 639-45.
- Schlosser N.J.J., Steinmetz K.-O., Aubier M. et al. Evaluation of long term safety of salmeterol/fluticasone propionate (50/500 meg) combination inhaler in patients with reversible airways obstruction. // Eur Res J. — 1998. -12 (Suppl 28). — p. 328.
- Vathenen A.S., Knox A.J. Higgins et al. Rebound increase in bronchial responsiveness after treatment with inhaled terbutaline. //Lancet. — 1988. — 1. — p. 554-558.
- Wahedna I., Wong C.S. et al. Asthma control during and after cessation of regular beta2-agonist treatment.//Am Rev RespirDis. — 1993,- 148. — p. 707-712.
- Watson T.A., Becker A.B., Simsons F.E. Comparison of ipratropium solution Fenoterol solution and their combination administered by nebuliser and face mask to children with acute asthma.//J. Allergy. — 1988.-v. 82.-p. 1012-1018.
- Widdicombe J.G. The parasympathetic nervous system in air ways disease.// Scand J Respir Dis. — 1979. — 103 Supple. — p. 38-43.
- Woolcock A., Lundback B., Ringdal N. et al. Comparison of addition of salmeterol of inhaled steroid with doubling of the dose of inhaled corticosteroids. //Am J Respir Crit Care Med. — 1996. — 153. — p.1481-1488.
- Woolcock AJ. Beta agonist and asthma mortality, What have we learned? What questions remain ? //Drugs 1996, 40(5): 653-6
Для цитирования:
Синопальников А.И., Клячкина И.Л. b2-агонисты: роль и место в лечении бронхиальной астмы // РМЖ. 2002. №5. С. 236
Государственный институт усовершенствования врачей МО РФ, Москва
Введение
Терапия бронхиальной астмы (БА) может быть условно разделена на два основных направления. Первое - симптоматическая терапия, быстро и эффективно купирующая бронхоспазм, ведущий клинический симптом БА. Второе - противовоспалительная терапия, способствующая модификации главного патогенетического механизма заболевания, а именно, воспаления слизистой дыхательных путей (ДП) .
Центральное место среди средств симптоматического контроля БА, очевидно, занимают b 2 -агонисты, характеризующиеся выраженной бронхолитической активностью (и бронхопротективным действием) и минимальным числом нежелательных побочных явлений при их правильном использовании.
Краткая история b
2 -агонистов
История применения b
-агонистов в XX веке - это последовательная разработка и внедрение в клиническую практику лекарственных средств со все более возрастающей b
2 -адренергической селективностью и увеличивающейся продолжительностью действия.
Впервые симпатомиметик адреналин (эпинефрин) был использован в лечении больных БА в 1900 г. . Поначалу адреналин широко применялся как в инъекционной форме, так и в виде ингаляций. Однако неудовлетворенность врачей кратковременностью действия (1-1,5 ч), большим количеством негативных побочных эффектов препарата явилась стимулом к дальнейшему поиску более «привлекательных» лекарственных средств.
В 1940 г. появился изопротеренол - синтетический катехоламин. Он разрушался в печени так же быстро, как и адреналин (при участии фермента катехол-о-метилтрансферазы - КОМТ), и поэтому характеризовался небольшой продолжительностью действия (1-1,5 ч), а образующиеся в результате биотрансформации изопротеренола метаболиты (метоксипреналин) обладали b -адреноблокирующим действием. В то же время изопротеренол был свободен от таких нежелательных явлений, присущих адреналину, как головная боль, задержка мочи, артериальная гипертензия и др. Изучение фармакологических свойств изопротеренола привело к установлению гетерогенности адренорецепторов . По отношению к последним адреналин оказался универсальным прямым a -b -агонистом, а изопротеренол - первым короткодействующим неселективным b -агонистом .
Первым селективным b 2 -агонистом стал появившийся в 1970 г. сальбутамол , характеризовавшийся минимальной и клинически незначимой активностью в отношении a - и b 1 -рецепторов. Он по праву приобрел статус «золотого стандарта» в ряду b 2 -агонистов. За сальбутамолом последовало внедрение в клиническую практику других b 2 -агонистов (тербуталин, фенотерол и др.). Эти препараты оказались столь же эффективны в качестве бронхолитиков, как и неселективные b -агонисты, поскольку бронхолитический эффект симпатомиметиков реализуется только через b 2 -адренорецепторы. Вместе с тем b 2 -агонисты демонстрируют существенно менее выраженное стимулирующее воздействие на сердце (батмотропное, дромотропное, хронотропное) по сравнению с b 1 -b 2 -агонистом изопротеренолом .
Некоторые различия в селективности b 2 -агонистов не имеют серьезного клинического значения. Большая частота нежелательных кардиоваскулярных эффектов при приеме фенотерола (по сравнению с сальбутамолом и тербуталином) может быть объяснена большей эффективной дозой препарата и, отчасти, более быстрой системной абсорбцией. У новых препаратов сохранилось быстродействие (наступление эффекта в первые 3-5 минут после ингаляции), характерное для всех предшествующих b -агонистов при заметном увеличении продолжительности их действия до 4-6 часов (менее выраженном при тяжелой БА). Это улучшало возможности контроля за симптомами БА в течение дня, но «не спасало» от ночных приступов .
Появившаяся возможность приема отдельных b 2 -агонистов внутрь (сальбутамол, тербуталин, формотерол, бамбутерол) в некоторой степени решала проблему контроля ночных приступов БА. Однако необходимость принимать значительно более высокие дозы (почти в 20 раз больше, чем при ингаляционном применении) способствовала появлению нежелательных явлений, связанных со стимуляцией a - и b 1 -адренорецепторов. Кроме того, была выявлена и более низкая терапевтическая эффективность этих препаратов .
Значительно изменило возможности терапии БА появление пролонгированных ингаляционных b 2 -агонистов - сальметерола и формотерола. Первым появился на рынке сальметерол - высокоселективный b 2 -агонист, демонстрирующий продолжительность действия, по крайней мере, в течение 12 часов, но с медленным началом действия. Вскоре к нему «присоединился» формотерол , также являющийся высокоселективным b 2 -агонистом с 12-часовым действием, но со скоростью развития бронходилатационного эффекта, аналогичной таковой сальбутамола . Уже в первые годы применения пролонгированных b 2 -агонистов было отмечено, что они способствуют урежению обострений БА, уменьшению количества госпитализаций, а также снижению потребности в ингаляционных кортикостероидах (ИГКС).
Наиболее эффективным путем введения лекарственных препаратов при БА, в том числе и b 2 -агонистов, признан ингаляционный. Важными преимуществами этого пути являются возможность непосредственной доставки лекарственных препаратов к органу-мишени (что в значительной степени обеспечивает быстродействие бронходилататоров) и минимизация нежелательных эффектов. Из известных в настоящее время средств доставки наиболее часто используются дозированные аэрозольные ингаляторы (ДАИ), реже дозированные порошковые ингаляторы (ДПИ) и небулайзеры. Пероральные b 2 -агонисты в виде таблеток или сиропов применяются крайне редко, главным образом как дополнительное средство при частых ночных симптомах БА или высокой потребности в ингаляционных короткодействующих b 2 -агонистах у больных, получающих высокие дозы ИГКС (эквивалентные 1000 мкг беклометазона в сутки и более) .
Механизмы действия b
2 -агонистов
b
2 -агонисты вызывают бронходилатацию в первую очередь в результате непосредственной стимуляции b
2 -адренорецепторов гладких мышц ДП. Доказательства этого механизма были получены как in vitro
(при воздействии изопротеренола происходило расслабление бронхов человека и отрезков легочной ткани), так и in vivo
(быстрое падение сопротивления ДП после ингаляций бронхолитика) .
Стимуляция b -адренорецепторов приводит к активации аденилатциклазы, образущей комплекс с G-протеином (рис.1), под воздействием которого повышается содержание внутриклеточного циклического аденозин-3,5-монофосфата (цАМФ). Последнее приводит к активации специфической киназы (протеинкиназы А), которая фосфорилирует некоторые внутриклеточные белки, в результате чего происходит снижение внутриклеточной концентрации кальция (активное его «перекачивание» из клетки во внеклеточное пространство), тормозится гидролиз фосфоинозитида, ингибируются киназы легких цепей миозина и, наконец, «открываются» большие кальций-активируемые калиевые каналы, обусловливающие реполяризацию (расслабление) гладкомышечных клеток и секвестрацию кальция во внеклеточное депо. Нужно сказать, что b 2 -агонисты могут связываться с калиевыми каналами и непосредственно вызывать релаксацию гладкомышечных клеток независимо от повышения внутриклеточной концентрации цАМФ .
Рис.1. Молекулярные механизмы, участвующие в бронходилатационном эффекте b 2 -агонистов (объяснения в тексте). К Са - большой кальцийактивируемый калиевый канал; АТФ - аденозинтрифосфат; цАМФ - циклический аденозин-3,5-моносфат
b 2 -агонисты рассматриваются как функциональные антагонисты, обусловливающие обратное развитие бронхоконстрикции вне зависимости от имевшего место констрикторного воздействия. Это обстоятельство представляется чрезвычайно важным, поскольку многие медиаторы (медиаторы воспаления и нейротрансмиттеры) обладают бронхоконстрикторным действием.В результате воздействия на b -адренорецепторы, локализующиеся в различных отделах ДП (табл. 1), выявляются дополнительные эффекты b 2 -агонистов, которые объясняют возможность профилактического использования препаратов. В их числе угнетение высвобождения медиаторов из клеток воспаления, уменьшение проницаемости капилляров (предотвращение развития отека слизистой бронхов), угнетение холинергической передачи (уменьшение холинергической рефлекторной бронхоконстрикции), модуляция продукции слизи подслизистыми железами и, следовательно, оптимизация мукоцилиарного клиренса (рис. 2).
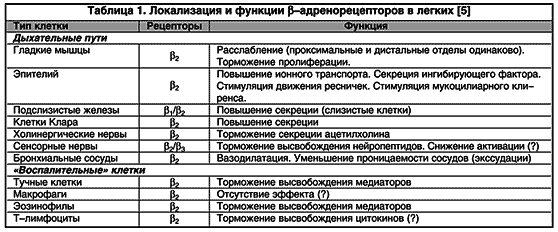

Рис. 2. Прямой и непрямой бронходилатационный эффект b 2 -агонистов (объяснения в тексте). Э - эозинофил; ТК - тучная клетка; ХН - холинергический нерв; ГмК - гладкомышечная клетка
Согласно микрокинетической диффузионной теории G.Andersen , продолжительность и время начала действия b 2 -агонистов связаны с их физико-химическими свойствами (в первую очередь липофильностью/гидрофильностью молекулы) и особенностями механизма действия. Сальбутамол - гидрофильное соединение. Попадая в водную среду внеклеточного пространства, он быстро проникает в «сердцевину» рецептора и после прекращения связи с ним удаляется путем диффузии (рис. 3). Сальметерол , созданный на основе сальбутамола, высоко липофильный препарат, быстро проникает в мембраны клеток дыхательных путей, выполняющих функцию депо, и затем медленно диффундирует через мембрану рецептора, обусловливая его длительную активацию и более позднее начало действия. Липофильность формотерола меньше, чем у сальметерола, поэтому он образует депо в плазматической мембране, откуда диффундирует во внеклеточную среду и затем одновременно связывается с b -адренорецептором и липидами, что обусловливает и быстроту наступления эффекта, и увеличение его продолжительности (рис. 3). Продолжительный эффект сальметерола и формотерола объясняется их способностью длительное время находиться в бислое клеточных мембран гладкомышечных клеток в непосредственной близости от b 2 -адренорецепторов и взаимодействовать с последними.

Рис. 3. Механизм действия b 2 -агонистов (объяснения в тексте)
При исследовании in vitro спазмированная мышца расслабляется быстрее при добавлении формотерола, нежели сальметерола. Это подтверждает то, что сальметерол является частичным агонистом b 2 -рецепторов относительно формотерола .
Рацематы
Селективные b
2 -агонисты представляют из себя рацемические смеси (50:50) двух оптических изомеров - R и S. Установлено, что фармакологическая активность R-изомеров в 20-100 раз выше, чем S-изомеров. Показано, что R-изомер сальбутамола проявляет свойства бронхолитика. В то же время S-изомер проявляет прямо противоположные свойства: провоспалительное действие, увеличение гиперреактивности ДП, усиление бронхоспазма, кроме того, он значительно медленнее метаболизируется. Недавно был создан новый препарат, содержащий только R-изомер (левалбутерол
). Он существует пока только в растворе для небулайзеров и имеет лучший терапевтический эффект, чем рацемический сальбутамол , так как эквивалентный эффект левалбутерол демонстрирует в дозе, равной 25% рацемической смеси (нет противодействующего S-изомера, уменьшено и количество нежелательных явлений) .
Селективность b
2 -агонистов
Цель применения селективных b
2 -агонистов состоит в том, чтобы обеспечить бронходилатацию и при этом избежать нежелательных явлений, индуцируемых стимуляцией a
- и b
1 -рецепторов. В большинстве случаев умеренное применение b
2 -агонистов не ведет к развитию нежелательных эффектов. Однако селективность не может полностью устранить риск их развития, и тому есть несколько объяснений.
Прежде всего, селективность к b 2 -адренорецепторам всегда относительна и дозозависима. Незначительная активация a - и b 1 -адренорецепторов, незаметная при обычных среднетерапевтических дозах, становится клинически значимой при увеличении дозы препарата или частоты его приема в течение дня. Дозозависимый эффект b 2 -агонистов необходимо учитывать при лечении обострений БА, особенно жизнеугрожающих состояний, когда повторные ингаляции в течение короткого времени (нескольких часов) в 5-10 раз превышают допустимую суточную дозу.
b 2 -рецепторы широко представлены в ДП (табл. 1). Плотность их увеличивается по мере уменьшения диаметра бронхов, а у больных БА плотность b 2 -рецепторов в дыхательных путях выше, чем у здоровых. Многочисленные b 2 -адренорецепторы найдены на поверхности тучных клеток, нейтрофилов, эозинофилов, лимфоцитов . И в то же время b 2 -рецепторы находят в разнообразных тканях и органах, особенно в левом желудочке, где они составляют 14% всех b -адренорецепторов, и в правом предсердии - 26% всех b -адренорецепторов . Стимуляция этих рецепторов может привести к развитию нежелательных явлений, включая тахикардию, трепетание предсердий и ишемию миокарда. Стимуляция b 2 -рецепторов скелетных мышц может вызвать мышечный тремор. Активация больших калиевых каналов может способствовать развитию гипокалиемии и, как следствие этого - удлинению интервала QT и нарушениям сердечного ритма, в т.ч. фатальным. При системном введении больших доз препаратов могут наблюдаться метаболические эффекты (увеличение уровня свободных жирных кислот в сыворотке крови, инсулина, глюкозы, пирувата и лактата) .
При стимуляции сосудистых b 2 -рецепторов развивается вазодилатация и возможно снижение диастолического артериального давления. Особенно выражены нежелательные кардиальные эффекты в условиях тяжелой гипоксии во время обострений БА - увеличение венозного возврата (особенно в положении ортопноэ) может вызвать развитие синдрома Bezold-Jarisch с последующей остановкой сердца .
Связь между b
2 -агонистами и воспалением в ДП
В связи с широким использованием b
2 -агонистов короткого действия, а также внедрением в клиническую практику пролонгированных ингаляционных b
2 -агонистов стал особенно актуальным вопрос о том, обладают ли эти препараты противовоспалительным действием. Несомненно, противовоспалительным эффектом b
2 -агонистов, способствующим модификации острого воспаления бронхов, можно считать угнетение высвобождения медиаторов воспаления из тучных клеток и уменьшение проницаемости капилляров. В то же время при биопсии слизистой бронхов больных БА, регулярно принимающих b
2 -агонисты, было установлено, что число клеток воспаления, в т.ч. и активированных (макрофаги, эозинофилы, лимфоциты) не уменьшается .
При этом теоретически регулярный прием b 2 -агонистов может даже привести к усугублению воспаления в ДП. Так, обусловливаемая b 2 -агонистами бронходилатация позволяет осуществить более глубокий вдох, результатом чего может стать более массивная экспозиция аллергенов.
Кроме того, регулярное применение b 2 -агонистов может маскировать развивающееся обострение, тем самым задерживая начало или усиление истинной противовоспалительной терапии.
Потенциальный риск использования b
2 -агонистов
Толерантность
Частое регулярное применение ингаляционных b
2 -агонистов может привести к развитию толерантности (десенситизации) к ним. Накопление цАМФ способствует переходу рецептора в неактивное состояние. Чрезмерно интенсивная стимуляция b
-адренорецепторов способствует развитию десенситизации (уменьшению чувствительности рецепторов в результате разобщения рецептора с G-протеином и аденилатциклазой) . При сохранении избыточной стимуляции уменьшается число рецепторов на поверхности клетки («down»-регуляция). Нужно отметить, что b
-рецепторы гладких мышц ДП имеют довольно значительный резерв и поэтому они более устойчивы к десенситизации, чем рецепторы нереспираторных зон (например, скелетной мускулатуры или регулирующие метаболизм). Установлено, что у здоровых лиц быстро развивается толерантность к высоким дозам сальбутамола, а к фенотеролу и тербуталину - нет. Вместе с тем у больных БА толерантность к бронхолитическому эффекту b
2 -агонистов появляется редко, гораздо чаще развивается толерантность к их бронхопротективному действию.
Уменьшение бронхопротективного действия b 2 -агонистов при их регулярном, частом применении в равной степени касается и короткодействующих, и пролонгированных препаратов даже на фоне базисной терапии ингаляционными кортикостероидами. В то же время речь идет не о полной потере бронхопротекции, а о небольшом снижении ее первоначального уровня. H.J.van der Woude et al. установили, что на фоне регулярного применения больными БА формотерола и сальметерола бронхолитический эффект последних не снижается, бронхопротективное действие оказывается выше у формотерола, но при этом значительно меньше выражено бронхолитическое действие сальбутамола.
Десенситизация развивается длительно, в течение нескольких дней или недель, в отличие от тахифилаксии, которая развивается очень быстро и не связана с функциональным состоянием рецепторов. Это обстоятельство объясняет снижение эффективности лечения и требует ограничения частоты применения b 2 -агонистов .
Индивидуальную вариабельность ответа на b 2 -агонисты и развития толерантности к их бронходилатирующему эффекту многие исследователи связывают с генетическим полиморфизмом генов. Ген b 2 -адренорецепторов локализуется на 5q хромосоме. Существенное влияние на течение БА и эффективность лечения оказывает изменение аминокислотной последовательности b 2 -адренорецепторов, в частности, перемещение аминокислот в 16 и 27 кодонах. Влияние полиморфизма генов не распространяется на вариабельность бронхопротективного эффекта. Справедливости ради надо отметить, что эти данные подтверждаются не во всех работах .
b 2 -агонисты и смертность больных БА
Серьезные сомнения в безопасности ингаляционных b -агонистов возникли в 60-х годах ХХ столетия, когда в ряде стран, в том числе Англии, Австралии, Новой Зеландии разразилась «эпидемия смертей» среди больных БА . При этом высказывалось предположение о связи между терапией симпатомиметиками и увеличением смертности от БА. Причинно-следственные взаимоотношения между применением b -агонистов (изопротеренола) и возросшей смертностью тогда не были установлены, а по результатам ретроспективных исследований доказать их было практически невозможно. Связь же между приемом фенотерола и повышением смертности от БА в Новой Зеландии в 80-е годы удалось доказать, поскольку было установлено, что этот препарат чаще назначался в случаях фатальной БА, по сравнению с хорошо контролируемым заболеванием. Эта связь была косвенно подтверждена и снижением смертности, совпавшей с отменой широкого приема фенотерола (при общем увеличении продаж других b 2 -агонистов). В этом плане показательны результаты эпидемиологического исследования в Канаде, ставившего своей целью изучить возможную связь между частотой летальных исходов и назначаемыми лекарственными средствами . Было показано, что возрастание частоты летальных исходов ассоциируется с высокодозной терапией любым из доступных ингаляционных b 2 -агонистов. Риск фатального исхода был наибольшим при применении фенотерола, однако при упорядоченном сравнении с эквивалентными дозами сальбутамола показатели смертности достоверно не отличались.
В то же время связь между высокодозной терапией b 2 -агонистами и увеличением смертности от БА надежно доказать не удается, поскольку больные с более тяжелой и плохо контролируемой БА чаще прибегают к помощи высоких доз b 2 -агонистов и, напротив, реже - к помощи эффективных противовоспалительных лекарственных средств. Кроме того, высокие дозы b 2 -агонистов маскируют признаки нарастающего фатального обострения БА .
Режим дозирования
Ингаляционные короткодействующие b
2 -агонисты
Не вызывает сомнений тот факт, что ингаляционные короткодействующие b
2 -агонисты являются препаратами выбора для ситуационного симптоматического контроля БА , а также для предупреждения развития симптомов астмы физического усилия (АФУ). Регулярное же применение ингаляционных b
-агонистов может привести к утрате адекватного контроля над течением заболевания. Так, в исследовании, проведенном M.R. Sears et al. в Новой Зеландии , изучались бронхиальная гиперреактивность, утренняя ПСВ, ежедневные симптомы и потребность в ИГКС у пациентов, использующих b
2 -агонисты «по требованию», по сравнению с больными, применяющими фенотерол регулярно 4 раза в день. В группе больных с регулярным приемом фенотерола наблюдался плохой контроль над симптомами БА, кроме того, отмечались более частые и тяжелые обострения по сравнению с группой больных, применяющих b
2 -агонисты «по требованию» в течение полугода. У последних же наблюдались улучшение показателей функции внешнего дыхания, утренней ПСВ, снижение ответа на бронхопровокационную пробу с метахолином. Повышение гиперреактивности бронхов на фоне регулярного приема короткодействующих b
2 -агонистов, скорее всего, связано с наличием S-энантомеров в рацемической смеси препарата .
В отношении сальбутамола подобные закономерности установить не удалось, хотя, как и в случае с фенотеролом, его регулярный прием сопровождался незначительным возрастанием бронхиальной гиперреактивности. Имеются отдельные доказательства того, что регулярное применение сальбутамола сопровождается возрастанием частоты эпизодов АФУ и увеличением выраженности воспаления в ДП .
Короткодействующие b 2 -агонисты должны использоваться (в т.ч. и в рамках монотерапии) только «по требованию». Маловероятно, что обычно рекомендуемый режим дозирования b 2 -агонистов «по требованию» может ухудшить контроль над течением БА, однако при использовании высоких доз препарата ухудшение контроля становится реальным. Более того, многие больные становятся особенно чувствительными к агонистам при наличии полиморфизма b 2 -адренорецепторов, что обусловливает более быстрое ухудшение контроля . Связь, установленная между повышением риска смерти у больных БА и применением высоких доз ингаляционных b 2 -агонистов, отражает лишь степень тяжести заболевания. Возможно также, что высокие дозы ингаляционных b 2 -агонистов оказывают вредоносное воздействие на течение БА . Больные, получающие высокие дозы b 2 -агонистов (более 1,4 баллончика аэрозоля в месяц), безусловно, нуждаются в эффективной противовоспалительной терапии, в т.ч. и с целью уменьшения дозы b 2 -агонистов . При увеличении потребности в бронходилататорах (чаще трех раз в неделю) показано дополнительное назначение противовоспалительных препаратов, а при употреблении b 2 -агонистов более 3-4 раз в день для купирования симптомов - увеличение их дозы.
Прием короткодействующих b 2 -агонистов с целью бронхопротекции также ограничивается «разумными пределами» (не более 3-4 раз в сутки). Бронхопротективные свойства b 2 -агонистов позволяют многим высококвалифицированным спортсменам, страдающим БА, выступать в соревнованиях международного уровня (правила позволяют использовать короткодействующие b 2 -агонисты для профилактики АФУ при условии, что заболевание врачебно верифицировано). Так, например, на Олимпийских играх 1984 г. в Лос-Анджелесе принимали участие 67 спортсменов с АФУ, из которых 41 получил медали разного достоинства . Известно, что пероральные b 2 -агонисты способствуют повышению работоспособности за счет увеличения мышечной массы, белкового и липидного анаболизма, психостимуляции . В исследовании С.Goubart et al. было показано, что влияние ингаляционных b 2 -агонистов у здоровых спортсменов ограничивается лишь небольшой бронходилатацией, которая, впрочем, может вносить существенный вклад в улучшение дыхательной адаптации в начале нагрузки.
Пролонгированные ингаляционные b 2 -агонисты
Доступные в настоящее время пролонгированные ингаляционные b 2 -агонисты - формотерол и сальметерол оказывают свое действие в течение 12 часов с равноценным бронхолитическим эффектом. Тем не менее различия между ними есть. В первую очередь, это быстродействие формотерола (в форме ДПИ), сопоставимое со временем начала действия сальбутамола (в форме ДАИ) , что позволяет использовать формотерол в качестве средства скорой помощи, вместо короткодействующих b 2 -агонистов. В то же время нежелательных явлений при использовании формотерола существенно меньше, чем при применении сальбутамола . Эти препараты могут использоваться в качестве монотерапии у больных с легким течением БА в качестве бронхопротекторов при АФУ. При использовании формотерола чаще 2 раз в неделю «по требованию» необходимо добавлять к лечению ИГКС.
Следует отметить, что монотерапия пролонгированными b 2 -агонистами на регулярной основе не рекомендуется, так как до сих пор нет надежных доказательств их противовоспалительного, модифицирующего заболевание действия .
Есть научно обоснованные доказательства целесообразности комбинированного применения ИГКС и бронходилататоров. Кортикостероиды усиливают экспрессию b 2 -рецепторов и уменьшают потенциальную десенситизацию, в то время как пролонгированные b 2 -агонисты увеличивают чувствительность кортикостероидных рецепторов к ИГКС .
Проведенные к настоящему времени исследования свидетельствуют о возможности более раннего назначения пролонгированных ингаляционных b 2 -агонистов. Так, например, у больных с неадекватным контролем астмы на фоне приема 400-800 мкг ИГКС дополнительное назначение сальметерола обеспечивает более полный и адекватный контроль по сравнению с увеличением дозы ИГКС. Формотерол демонстрирует сходный эффект и одновременно способствует уменьшению частоты обострений заболевания. Эти и ряд других исследований свидетельствуют о том, что добавление пролонгированных ингаляционных b 2 -агонистов к низко-среднедозовой терапии ИГКС у больных с неадекватным контролем БА равноценно удвоению дозы стероидов .
В настоящее время рекомендовано использовать пролонгированные ингаляционные b 2 -агонисты только у больных, одновременно получающих ИГКС. Многообещающими представляются фиксированные комбинации, такие как сальметерол с флютиказоном (Серетид) и формотерол с будесонидом (Симбикорт). При этом отмечается лучшая комплаентность, исключается риск использования только одного из препаратов в рамках длительной терапии заболевания.
Литература:1. National Institutes of Health, National Heart, Lung, and Blood Institute. Expert Panel Report 2: Guidelines for the Diagnosis and Management of Asthma. Bethesda, Md: National Institutes of Health, National Heart, Lung, and Blood Institute; April 1997. NIH publication 97-4051.
2. Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология. В 2-х томах. Москва: Медицина; 1991 г.
3. Машковский М.Д. Лекарственные средства. Москва: Медицина; 1984 г.
4. Show M. B2-agonists, from pharmacological properties to everyday clinical practice. International workshop report (based on a workshop held in London, UK February 28-29, 200)
5. Barnes P.J. b -Agonists, Anticholinergics, and Other Nonsteroid Drugs. In: Albert R., Spiro S., Jett J., editors. Comprehensive Respiratory Medicine. UK:Harcourt Publishers Limited; 2001. p.34.1-34-10
6. Updating guidelines on asthma in adults (editorial). BMJ 2001; 323:1380-1381.
7. Jonson M. b 2 -adrenoceptor agonists: optimal pharmacological profile. In: The role of b 2 -agonists in asthma management. Oxford: The Medicine Group; 1993. p. 6-8.
8. Barnes P.J. beta-adrenergic receptors and their regulation. Am J Respir Crit Care Med. 1995; 152:838-860.
9. Kume H., Takai A., Tokuno H., Tomita T. Regulation of Ca 2 + dependent K+-channel activity in tracheal myocytes by phosphorylation. Nature 1989; 341:152-154.
10. Anderson G.P. Long acting inhaled beta-adrenoceptor agonists: the comparative pharmacology of formoterol and salmeterol. Agents Actions Suppl. 1993; 43:253-269.
11. Stiles GL, Taylor S, Lefkowitz RJ. Human cardiac beta-adrenergic receptors: subtype heterogeneity delineated by direct radioligand binding. Life Sci. 1983; 33:467-473.
12. Prior JG, Cochrane GM, Raper SM, Ali C, Volans GN. Self-poisoning with oral salbutamol. BMJ. 1981; 282:1932.
13. Handley D. The asthma-like pharmacology and toxicology of (S)-isomers of beta agonists. J Allergy Clin Immunol. 1999;104: S69-S76.
14. .Jonson M., Coleman R. Mechanisms of action beta-2-adrenoceptor agonists. In: Bisse W., Holgate S., editorials. Asthma and Rhinitis. Blackwell Science; 1995. p.1278-1308.
15. Burggsaf J., Westendorp R.G.J., in’t Veen J.C.C.M et al. Cardiovascular side effects of inhaled salbutamol in hypoxic asthmatic patients. Thorax 2001; 56: 567-569.
16. Van Shayck C.P., Bijl-Hoffland I.D., Closterman S.G.M. et al. Potential masking effect on dispnoea perception by short- and long-acting b 2 -agonists in asthma. ERJ 2002; 19:240-245.
17. Van der Woude H.J., Winter T.N., Aalbers R. Decreased bronchodilating effect of salbutamol in relieving methacholine induced moderate to severe bronchoconstriction during high dose treatment with long acting b 2 agonists. Thorax 2001; 56: 529-535.
18. Nelson HS. Clinical experience with levalbuterol. J Allergy Clin Immunol. 1999; 104:S77-S84.
19. Lipworth BJ, Hall IP, Tan S, Aziz I, Coutie W. Effects of genetic polymorphism on ex vivo and in vivo function of b 2 -adrenoceptors in asthmatic patients. Chest 1999;115:324-328.
20. Lipworth BJ, Kopelman G.H., Wheatley A.P. et al. b 2 -adrenoceptor promoter polymorphism: extended halotypes and functional effects in peripheral blood mononuclear cells. Thorax 2002; 57: 61-66.
21. Lima JJ, Thomason DB, Mohamed MH, Eberle LV, Self TH, Johnson JA. Impact of genetic polymorphisms of the b 2 -adrenergic receptor on albuterol bronchodilator pharmacodynamics. Clin Pharm Ther 1999; 65:519-525.
22. Kotani Y, Nishimura Y, Maeda H, Yokoyama M. b 2 -adrenergic receptor polymorphisms affect airway responsiveness to salbutamol in asthmatics. J Asthma 1999; 36:583-590.
23. Taylor D.R., Sears M.R., Cockroft D.W. The beta-agonist controversy. Med Clin North Am 1996; 80: 719-748.
24. Spitzer WO, Suissa S, Ernst P, et al. The use of beta-agonists and the risk of death and near death from asthma. N Engl J Med 1992; 326:501-506.
25. Sears MR, Taylor DR, Print CG, et al. Regular inhaled beta-agonist treatment in bronchial asthma. Lancet 1990; 336:1391-1396.
26. Handley D. The asthma-like pharmacology and toxicology of (S)-isomers of beta agonists. J Allergy Clin Immunol. 1999; 104:S69-S76.
27. Nelson HS. Clinical experience with levalbuterol. J Allergy Clin Immunol 1999;104:S77-S84.
28. Liggett S.B. Polymorphisms of the b 2 -adrenergic receptor in asthma. Am J Respir Cri. Care Med 1997; 156: S 156-162.
29. Voy R.O. The US Olympic Commitee experience with exercise-induced bronchospasm. Med Sci Exerc 1986; 18:328-330.
30. Lafontan M, Berlan M, Prud’hon M. Les agonistes beta-adrenergiques. Mecanismes d’action: lipomobilisation et anabolisme. Reprod Nutr Develop 1988; 28:61-84
31. Martineau L, Horan MA, Rothwell NJ, et al. Salbutamol, a b 2 -adrenoceptor agonist, increases skeletal muscle strength in young men. Clin Sci 1992; 83: 615-621.
32. Price AH, Clissold SP. Salbutamol in the 1980s. A reappraisal of its clinical efficacy. Drugs 1989; 38: 77-122.
33. Goubault C, Perault M-C, Leleu et al. Effects of inhaled salbutamol in exercising non-asthmatic athletes Thorax 2001; 56: 675-679.
34. Seberova E, Hartman P, Veverka J, et al. Formoterol given by Turbuhaler® had a rapid onset of action as salbutamol given by pMDI. Program and abstracts of the 1999 International Conference of the American Thoracic Society; April 23-28, 1999; San Diego, California. Abstract A637.
35. Wallin A., Sandstrom T., Soderberg M. et al. The effects of regular inhaled formoterol, budesonide, and placebo on mucosal inflammation and clinical indices of mild asthma. Am J Respir Crit Care Med. 1998; 158:79-86.
36. Greening AP, Ind PW, Northfield M, Shaw G. Added salmeterol versus higher-dose corticosteroid in asthma patients with symptoms on existing inhaled corticosteroid. Allen & Hanburys Limited UK Study Group. Lancet. 1994; 334:219-224.


